
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂.摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物.某学习小组欲探究其分解产物.
(1)甲组同学设计了如图1所示实验装置. 
(i)实验中,装置B中观察到的现象是 .
(ii)碱石灰的主要作用是 .
(iii)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有(写化学式).
(iv)设计实验验证装置A中固体残留物不含FeO:(简要说明实验操作、现象和结论).
(2)乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2 . 为进行验证,用甲组实验中的装置A和下列如图2所示装置进行实验.
说明此固体产物不含FeO|多余
(i)乙组同学的实验装置中,依次连接的合理顺序为A、 . 装置G中盐酸的作用是
(ii)实验中,准确称量摩尔盐7.8400g,充分加热反应后,测得装置A中固体残留物的质量为1.6000g,装置G中生成白色沉淀的质量为3.4950g,装置H中收集到112mL N2(标准状况下),写出摩尔盐受热分解的化学方程式: . (分解产物被充分吸收,不考虑其损失)
【答案】
(1)白色固体变蓝色;吸收分解产生的酸性气体;NH3;取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,
(2)G、E、F、H;吸收氨气并将溶液酸化,排除SO2的干扰;4[(NH4)2Fe(SO4)2?6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O
【解析】解:(1)(i)装置B无水硫酸铜是检验分解产物水,所以看到的现象为白色固体变蓝色,所以答案是:白色固体变蓝色;(ii)碱石灰的主要作用是吸收分解产生的酸性气体,所以答案是:吸收分解产生的酸性气体;(iii)装置D中观察到酚酞溶液变红色,说明有碱性气体产生即NH3 , 所以由此可知摩尔盐分解的产物中有NH3;所以答案是:NH3;(iv)利用二价铁离子具有还原性设计实验检验,实验设计为:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,证明此固体产物不含FeO,
所以答案是:取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色,说明此固体产物不含FeO;(2)(i)要检验生成SO3(g)、SO2(g)及N2 , 在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3 , 再通过品红溶液检验SO2 , 用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、E、F、H,由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰;
所以答案是:G、E、F、H;吸收氨气并将溶液酸化,排除SO2的干扰;(ii)根据以上分析,测得装置A中固体残留物即氧化铁的质量为1.6000g,则n(Fe2O3)= ![]() =0.01mol,装置G中生成白色沉淀即硫酸钡的质量为3.4950g,则根据氯化钡溶液检验SO3及硫原子守恒,所以n(SO3)=
=0.01mol,装置G中生成白色沉淀即硫酸钡的质量为3.4950g,则根据氯化钡溶液检验SO3及硫原子守恒,所以n(SO3)= ![]() =0.015mol,装置H中收集到112mL N2(标准状况下)即
=0.015mol,装置H中收集到112mL N2(标准状况下)即 ![]() =0.005mol,根据得失电子守恒,则生成二氧化硫的物质的量为:
=0.005mol,根据得失电子守恒,则生成二氧化硫的物质的量为: ![]() =0.025mol,所以生成物中Fe2O3:SO3:SO2:N2=2:3:5:1;所以根据原子守恒,摩尔盐受热分解的化学方程式为:4[(NH4)2Fe(SO4)26H2O]
=0.025mol,所以生成物中Fe2O3:SO3:SO2:N2=2:3:5:1;所以根据原子守恒,摩尔盐受热分解的化学方程式为:4[(NH4)2Fe(SO4)26H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O,所以答案是:4[(NH4)2Fe(SO4)26H2O]
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O,所以答案是:4[(NH4)2Fe(SO4)26H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O.
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+H2O.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
A.原子序数:X<YB.原子半径:X<YC.离子半径:X>YD.电负性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO3(g),反应过程中能量的变化如图所示。
2SO3(g),反应过程中能量的变化如图所示。
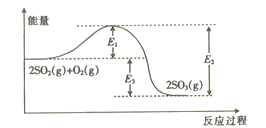
(1)由图可知该反应的正反应为_____________(填“吸热”或“放热”)反应。
(2)升高温度,平衡向_________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率_____________。
(3)向反应体系中加入催化剂后,图中E1____(填“增大”“减小”或“不变”,下同),E3___________。
(4)已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-442.4 kJ·mol-1;
S(s)+O2(g)=SO2(g) △H=-297.0 kJ mol-1。
则H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是_________________,当此反应转移3 mol电子时,放出的热量为_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物.一种用硼镁矿(Mg2B2O5H2O)制取单质硼的工艺流程图如下: 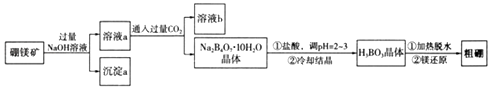
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为 .
(2)溶液b中溶质的化学式为 .
(3)用pH试纸测溶液pH的操作方法是 .
(4)写出Mg2B2O5H2O与盐酸反应的化学方程式:
(5)制得的粗硼在一定条件下生成BI3 , BI3加热分解可以得到纯净的单质硼.现将0.0200g粗硼制成的BI3完全分解,生成的I2用0.3000mo1.L﹣1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液15.00mL.(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)
①滴定操作中指示剂通常为
②该粗硼样品的纯度为 .
③若滴定管在使用前未用Na2S2O3标准溶液润洗,测得样品的纯度将(填“偏高”、“偏低”或“无影响”).
(6)请仿照如图形式设计从沉淀a中获得单质Mg的流程图(提示:在箭头上方或下方标出所用试剂或实验操作). ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。
(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是__________________________;配制完毕后要加入少量铁屑,其目的是__________________________。把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是___________,AlCl3溶液呈酸性的原因是(用离子方程式说明)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、混合物、电解质、非电解质顺序组合正确的一组为( )
A.浓硫酸、空气、小苏打、乙醇
B.生石灰、漂白粉、铁、二氧化硫
C.明矾、盐酸、碳酸钙、氯气
D.冰水混合物、氨水、纯碱、干冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物A含有两种阳离子和一种阴离子.将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24L(标准状况)刺激性气味的气体.向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60g. 请回答以下问题:
(1)A的摩尔质量为 .
(2)试通过计算确定该结晶水合物的化学式为 .
(3)若第二份加入75.00mL2.00molL﹣1的Ba(OH)2溶液,则得到的沉淀质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:下列说法不正确的是


A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH—- 2e—=CO32—+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com