
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
分析 ①NH3溶于水能导电和其本身无关;
②BaSO4投入水中能完全电离;
③在水溶液中或熔融状态下能导电的化合物为电解质;
④氯化钠溶液是混合物;
⑤单质既不是电解质也不是非电解质;
⑥强弱电解质的本质区别是能否完全电离.
解答 解:①NH3溶于水生成一水合氨,故氨水能导电和氨气本身无关,即氨气为非电解质,故错误;
②强弱电解质的本质区别是能否完全电离,而BaSO4投入水中能完全电离,故为强电解质,故错误;
③在水溶液中或熔融状态下能导电的化合物为电解质,由于盐酸能导电,故HCl为电解质,故正确;
④氯化钠溶液是混合物,故既不是电解质也不是非电解质,故错误;
⑤单质既不是电解质也不是非电解质,故硫单质不是电解质也不是非电解质,故错误;
⑥强弱电解质的本质区别是能否完全电离,CaCO3投入水中几乎不能导电,但能完全电离,故为强电解质,故错误.
故选A.
点评 本题考查了电解质、非电解质、强弱电解质的有关概念和区别,应注意的是强弱电解质的本质区别是能否完全电离,和溶解度无关.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
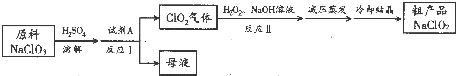
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的氯气可以贮存在钢瓶中 | |
| B. | 氯气是一种黄绿色的,强烈刺激性气味的有毒气体 | |
| C. | 工业上常用电解熔融氯化钠的方法制备氯气 | |
| D. | 氯气能给水进行消毒是因为氯气与水反应生成了HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.35mol/L | B. | 0.45mol/L | C. | 0.5mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
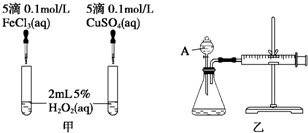
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com