
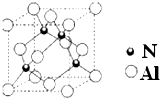
 【选做题--物质结构与性质】
【选做题--物质结构与性质】| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| ||
| 晶胞边长3 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| B、NH4+和CH4属于等电子体,立体构型都是正四面体 |
| C、BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 |
| D、向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
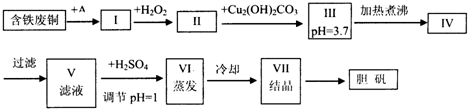
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
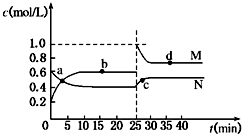
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫原子的2p轨道和氢原子的1s轨道 |
| B、硫原子的2p轨道和氢原子的2p轨道 |
| C、硫原子的3p轨道和氢原子的1s轨道 |
| D、硫原子的2p轨道和氢原子的3p轨道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com