
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 496 | 4 562 | 6 912 | 9 543 |
| S | 738 | 1 451 | 7 733 | 10 540 |
| T | 578 | 1 817 | 2 745 | 11 575 |
| U | 420 | 3 100 | 4 400 | 5 900 |


科目:高中化学 来源: 题型:
| A、能使酸性高锰酸钾溶液褪色 |
| B、在空气中久置,溶液pH变小 |
| C、能使溴水褪色 |
| D、加入氢氧化钡溶液产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl和KI |
| B、NaCl和I2 |
| C、KCl和NaBr |
| D、KCl和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.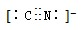
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 的有机物中,分子中最多有
的有机物中,分子中最多有查看答案和解析>>
科目:高中化学 来源: 题型:
| 需加入的试剂 | 分离装置 | |
| 苯(乙醇) | ||
| 乙烷(乙烯) | ||
| 乙醇(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4曾用作灭火剂,但因与水在高温下反应会产生有毒物质,现已被禁用 |
| B、工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 |
| C、Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 |
| D、为了延长果实或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com