
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
分析 ①非金属的非金属性越强,其最高价含氧酸的酸性越强;
②金属的非金属性越强,其最高价含氧酸的碱性越强;
③非金属性越强,氧化性越强;
④元素非金属性越强,氢化物越稳定,氢化物的还原性越弱.
解答 解:①非金属性Cl>Br>I,所以酸性HClO4>HBrO4>HIO4,故①正确;
②金属性Ba>Mg>B,所以碱性:Ba(OH)2>Mg(OH)2>B(OH)2,故②正确;
③非金属性F>O>Si,所以氧化性F>O>Si,故③错误;
④非金属性Cl>S>Si,所以还原性HCl<H2S<SiH4,故④正确;
故选C.
点评 本题考查元素周期律的递变规律,题目难度不大,掌握金属性和非金属性的判断依据是解题的关键,注意元素金属性和非金属性与单质或离子的还原性、氧化性的关系.


科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液的导电性强弱是由浓度决定的 | |
| B. | 弱电解质和强电解质的导电,都是由带电离子的定向移动引起的 | |
| C. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| D. | 导电性强的溶液中的自由移动离子数目一定比导电性弱的溶液中的自由移动离子数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
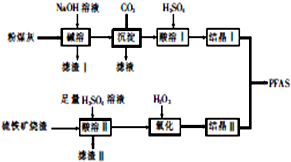 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
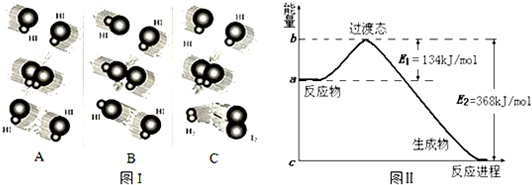
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L 0.1 mol•L-1的AlCl3溶液 | B. | 1 L 0.1 mol•L-1的FeCl2溶液 | ||
| C. | 1 L 1 mol•L-1的NaCl溶液 | D. | 1 L 2 mol•L-1的KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com