
反应A2+B2 2AB ΔH=QkJ/mol。在不同温度和压强改变条件下,产物AB的生成情况如图所示:a为500℃,b为300℃时的情况,c为300℃时从时间t3开始向容器加压的情况,则下列叙述正确的是
2AB ΔH=QkJ/mol。在不同温度和压强改变条件下,产物AB的生成情况如图所示:a为500℃,b为300℃时的情况,c为300℃时从时间t3开始向容器加压的情况,则下列叙述正确的是

A.AB为气体,A2、B2中最少有一种为非气体,Q>0
B.AB为气体,A2、B2中最少有一种为非气体,Q<0
C.AB为固体,A2、B2中最少有一种为非气体,Q<0
D.A2、B2、AB均为气体,Q>0
科目:高中化学 来源:2017届广东省高三上第一次阶段考化学试卷(解析版) 题型:选择题
下列有关实验操作、现象、解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇具有氧化性 |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
D | 用硫酸做催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉未发生水解 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:填空题
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:

①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化 率为 。
率为 。
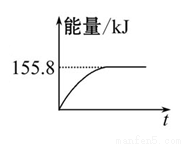
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) ?H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) ?H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是

A.从反应开始到t1时的平均反应速率
v(X)= mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
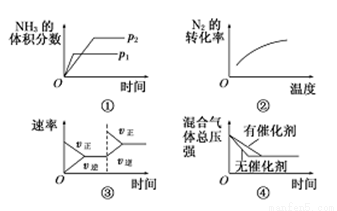
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:

①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上第一次大考化学卷(解析版) 题型:实验题
分实验室需要450 mL 1.0 mol·L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题。(已知所用98%浓硫酸的密度为1.84 g/mL)
①计算需98%的浓硫酸的体积;
②在烧杯中将浓硫酸稀释;
③接着将稀释后的硫酸转移到容量瓶中;
④洗涤烧杯和玻璃棒3次,并将洗涤液转移到容量瓶中;
⑤定容;
⑥摇匀。
(1)该实验中选用的定量仪器,除量筒外,还有________________。
(2)该实验应该用(多大规格)_____ ______的量筒(可供选择的量筒规格为10 mL、15 mL、20 mL、50 mL和100 mL),量取___________mL 98%的浓硫酸。
(3)①在配制过程中,如果没有洗涤烧杯和玻璃棒,其他操作都正确,那么所配溶液的实际浓度将_____________(填“偏大、偏小、无影响”)
②某同学转移溶液的操作如图所示,该同学操作中的错误是 。
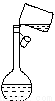
③若用胶头滴管定容时,不小心滴水滴过了刻度线,你认为应该采取的处理方法是: 。
④下列操作中,可能造成所配制溶液的浓度偏高的是 (填选项)。
a.溶解后没有冷却至室温就将液体转移至容量瓶中
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
d.用量筒量取浓硫酸,读数时仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上第一次大考化学卷(解析版) 题型:填空题
研究NO2、SO2、CO 等大气污染气体的处理具有重要意义。
等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状 况下是________L。
况下是________L。
(2)已知:2SO2(g)+O2(g) ?2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)?2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=___________kJ·mol-1。
SO3(g)+NO(g)的ΔH=___________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=___________。
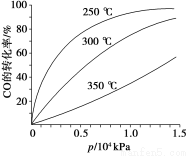
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH___________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应ΔH___________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是__________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g) ΔH<0
Z(g) ΔH<0 ,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A.以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的
C.其他条件不变,将容器体积缩小至5 L,平衡正向移动,
D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com