
【题目】欲配制浓度为1.00mol·L-1的氯化钠溶液100mL,用不到的仪器是
A. 容量瓶 B. 分液漏斗 C. 玻璃棒 D. 烧杯
科目:高中化学 来源: 题型:
【题目】下列各组中的反应属于同一反应类型的是( )
A.苯的硝化反应;乙烯使溴水褪色
B.葡萄糖与新制氢氧化铜共热;无水乙醇与浓硫酸共热制乙烯
C.乙醇和乙酸制乙酸乙酯;乙烷和氯气得到氯乙烷
D.乙醇和氧气制乙醛;苯和液溴制溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的SO2是引起酸雨的原因之一。
(1)每隔一定时间测定某处雨水样品的pH值:
![]()
雨水样品pH值变小的主要原因是____________________。
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
(3)判断已达到化学平衡状态的描述是______(选填编号)。
a.体系的压强不再发生变化 | b.2υ正(SO2)=υ逆(O2) |
c.c(SO2) = c(SO3) | d.气体总质量不再变化 |
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生。这种煤燃烧后,大部分硫元素最终转化为固体盐是_____________。
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:_____________________。
(6)Na2SO3溶液呈碱性,可吸收尾气SO2。Na2SO3溶液呈碱性的原因(用离子方程式表示)_____________________;常温下,0.1mol/L该溶液中离子浓度由大到小排列___________(用离子符号表示)。
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________。(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季是雾霾大气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(l)工业上利用甲烷催化还原NOx可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________。
(2)将CO2转化为甲醇可以实现废物利用,达到节能减排的目的,反应原理可表示为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。请回答:
0~3min内氢气的平均反应速率为______mol/(L·min);
第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和3molH2 (g),则达到平衡时CH3OH的体积分数_________(填“增大”、“减小”或“不变”)。

②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3___0(填“>”、“<”或“=”)。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。
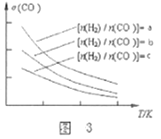
①a、b、c按从大到小的顺序排序为___________。
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______。
A.逆反应速率先增大后减小B.混合气体的密度增大
C.化学平衡常数K值减小D.氢气的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4]2Fe(SO4)2]是分析化学中的重要试剂。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行实验(夹持装置略)
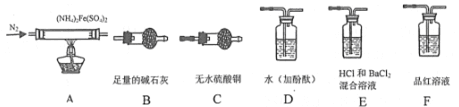
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为________(填装置的字母序号)。
②证明有水蒸气生成的实验现象为___________。
③证明有氨气生成的实验现象为_______________。
④A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:_________。
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是_________。
②B的作用是_________。
③实验证明(NH4]2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游离态的氮经一系列转化可以得到硝酸,如下图所示。

(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g) ![]() 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。

①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com