
| A.煤经气化和液化两个物理变化过程,可变为清洁能源 |
| B.国务院要求坚决控制钢铁水泥焦炭等行业产能总量是落实“低碳经济”的具体举措 |
| C.苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理 |
| D.“神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 |
科目:高中化学 来源:不详 题型:填空题

| | 天然气 | 石脑油 | 重油 | 煤焦 |
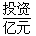 | 5.6 | 6.5 | 8.0 | - |
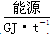 | 28~30 | 35.5 | 41.8 | 54.4 |
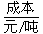 | 257 | 390~447 | 220~280 | 500 |
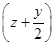 O2=MezOy+zSO2
O2=MezOy+zSO2 CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。
CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。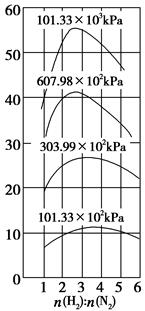
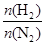 及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的
及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的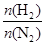 是________。
是________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ,其平衡常数表达式为K= 。
,其平衡常数表达式为K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.假说是对现实中已知事物或现象的一种简化处理 |
| B.假说是对未知领域的事物或现象提出的一种推测 |
| C.假说是对一个问题的所有幻想和假定 |
| D.假说最终都可以变成科学理论 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.能耗大是该方法的一大缺点 |
| B.整个过程中,有两种物质可以循环利用 |
| C.“反应分离”环节中,分离的基本操作是蒸发结晶、过滤 |
| D.“反应分离”环节中,发生了复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阿伦尼乌斯发现的质量守恒定律、拉瓦锡创立的电离学说、波尔提出的氢原子模型都对化学学科的发展作出了重要的贡献。 |
| B.山西王家岭煤矿2010年3·28透水事故被困工人,在井下靠吃木屑、树皮,喝凉水维持生命。木屑、树皮的化学成分主要是纤维素 |
| C.同位素示踪法是研究化学反应历程的手段之一 |
| D.绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
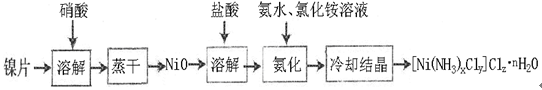
 LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为: 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com