
| 选项 | 实验操作 | 结论 |
| A | 相同条件下,分别测量0.1mol/L和0.01mol/L的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 向Co2O3固体中滴加浓盐酸,有黄绿色气体生成 | 氧化性:Co2O3>Cl2 |
| C | 向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝 | 淀粉未发生水解 |
| D | 常温下,分别测量浓度均为0.1mol/L的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液导电性与离子浓度大小有关,与醋酸的电离程度没有必然关系;
B.氧化还原反应中,氧化性:氧化剂>氧化产物;
C.溶液变蓝,只能说明淀粉没有完全水解,无法证明淀粉的水解程度;
D.Na2S对应的酸为HS-,应该测定等浓度的NaHS和NaClO溶液的pH.
解答 解:A.0.1mol/L和0.01mol/L的醋酸溶液,前者溶液中离子浓度较大,其导电性较强,但醋酸浓度越大,醋酸的电离程度越小,故A错误;
B.向Co2O3固体中滴加浓盐酸,有黄绿色气体生成,说明Co2O3将浓盐酸氧化成氯气,则氧化性:Co2O3>Cl2,故B正确;
C.向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝,说明淀粉没有完全水解,无法证明淀粉没有水解,故C错误;
D.常温下,分别测量浓度均为0.1mol/L的Na2S溶液和NaClO溶液的pH,前者的pH大,说明前者水解程度较大,但前者对应的酸为HS-,说明酸性:HClO>HS-,无法判断HClO、H2S的酸性强弱,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度中等,涉及电离平衡影响、淀粉水解、氧化还原反应、酸性强弱比较等知识,明确盐的水解原理及其影响为解答关键,试题有利于提高学生的灵活应用能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢气在在氯气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | CaCO3与稀盐酸反应制取CO2 | D. | CaO溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
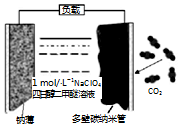 可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )
可充电“钠•二氧化碳”电池(如图),电池总反应为:4Na+3CO2$?_{充电}^{放电}$ 2Na2CO3+C,下列说法错误的是( )| A. | 放电时,Na+向正极移动 | |
| B. | 放电时,电子从钠薄经负载流向多壁纳米碳管 | |
| C. | 充电时,钠薄和外接电源的负极相连,发生氧化反应 | |
| D. | 充电时,阳极的电极反应为:2Na2CO3+C-4e-═4Na++3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的碳 | B. | 碳的化合物数量众多,分布极广 | ||
| C. | 向空气中排放二氧化碳会形成酸雨 | D. | 煤、石油、天然气属于可再生碳资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
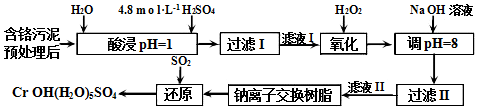
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
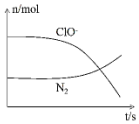 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com