
| 粒子符号 | 质子数Z | 中子数N | 核外电子数 | 质量数A |
| Cl | 17 | 20 | ||
| S2- | 18 | 32 | ||
| Al3+ | 14 | 27 | ||
| AYm- | y | A | ||
| AXn+ | x | A |
| 粒子符号 | 质子数Z | 中子数N | 核外电子数 | 质量数A |
| Cl | 17 | 20 | 17 | 37 |
| S2- | 16 | 16 | 18 | 32 |
| Al3+ | 13 | 14 | 10 | 27 |
| AYm- | A-y | y | A-y+m | A |
| AXn+ | x | A-x | A-x-n | A |


科目:高中化学 来源: 题型:
| A、等于1.06g |
| B、大于1.06g,小于2.86g |
| C、等于2.86g |
| D、大于2.86g |
查看答案和解析>>
科目:高中化学 来源: 题型:
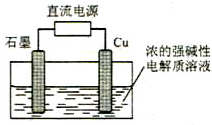 Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池如图,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池如图,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A、当有0.1mol电子转移时,有0.1molCu2O生成 |
| B、铜电极发生还原反应 |
| C、铜电极接直流电源的负极 |
| D、石墨电极上产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若把该反应设计为原电池,则正极反应为Fe2+-e-=Fe3+ |
| B、氧化产物为NH4+ |
| C、若转移5mole-有1 mol NO3-被还原 |
| D、氧化剂与还原剂物质的量之比为1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaOH溶液中滴加FeCl3饱和溶液 |
| B、向冷水中滴加饱和FeCl3溶液然后加热煮沸 |
| C、向加热煮沸的蒸馏水中逐滴加入少量饱和FeCl3溶液至呈红褐色 |
| D、向饱和的FeCl3溶液中滴加少量的热水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.00 molNaCl中含有6.02×1023个NaCl分子 |
| B、1.00molNaCl中,所有Na+的电子总数为8×6.02×1023 |
| C、电解58.5g 熔融的NaCl,能产生11.2L氯气(标准状况)、23.0g金属钠 |
| D、欲配置1.00L 1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com