
| A����ѧ����ʽ�а�����˳��ļ������ǣ�8��2��5��1��4��1��5 |
| B����Ӧ������������N2O |
| C����Ӧ������ת�Ƶĵ�����Ϊ8mol���� |
| D����������ͻ�ԭ��������ʵ���֮��Ϊ4��1 |


 ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| ʵ�� | �� | �� | �� | �� |
| V(HNO3)/ml | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ClO2�ǻ�ԭ���� |
| B��1 mol KClO3�μӷ�Ӧ��ʧȥ����Ϊ1 mol |
| C��H2C2O4�ڷ�Ӧ�б����� |
| D��H2C2O4�Ļ�ԭ�Դ���ClO2�Ļ�ԭ�� |
�鿴�𰸺ͽ���>>
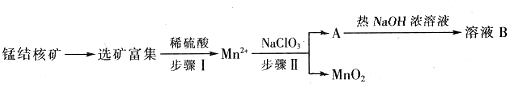
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��
��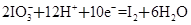
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������0.2mol CO2����ʱ����Һ�������ӵ����ʵ�������1mol |
| B���÷�Ӧ�У�ÿ��2molCN-��Ӧ��ת�Ƶ���Ϊ10mol |
| C��������Ӧ�еĻ�ԭ����OH- |
| D����ԭ�ԣ�C1-��CN- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 KI3
KI3| A��Na2S2O3 | B��AlCl3 | C��Na2CO3 | D��NaNO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�Ӧ�����������ΪS |
| B������1molH3AsO2ʱ��ת�Ƶ��Ӹ���Ϊ10NA |
| C������Ӧ��Ƴ�һԭ��أ���NO2Ӧ�������������ݳ� |
| D����Ӧ������NO2��56LO2�����ˮ��������ȫ��Ӧ�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com