
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H2S、HCl的热稳定性依次增强 |
| B、金刚石的熔沸点高于晶体硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、CH4、SiH4、GeH4、SnH4的沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、一定含有SO
| ||
B、一定含有CO
| ||
| C、可能有Ag+ | ||
D、一定有SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
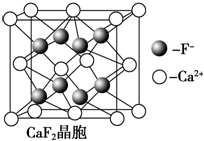
查看答案和解析>>
科目:高中化学 来源: 题型:
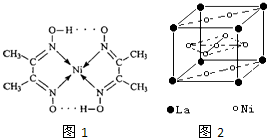 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力. 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
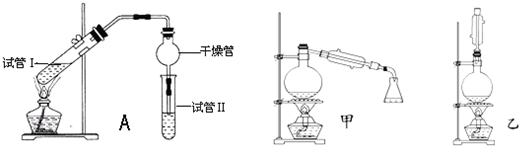
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL 18mol?L-1浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
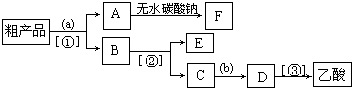
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com