
| A. | ②③④⑦⑧⑨ | B. | ③④⑤⑦⑧ | C. | ②③⑥⑦⑨ | D. | ④⑤⑥⑧ |
分析 化学变化的实质是在原子核不变的情况下,有新物质生成,分析各选项是否符合化学变化的概念,即有新物质生成,就是化学变化.
解答 解:①导电:有物理变化如:金属导电.例如:铜通电后仍为铜,无新物质生成,但氯化钠溶液导电是化学变化,故①错误;
②自行车车胎爆炸是物理变化,是气压过大造成,故②错误;
③所有的氧化反应都是化学变化,缓慢氧化,是指氧化反应进行得比较缓慢,故③正确;
④品红褪色的原因是二氧化硫与之发生了化学反应导致品红褪色,故④正确;
⑤无水硫酸铜由白变蓝,原来白色是硫酸铜,变蓝是生成了五水合硫酸铜,有新物质生成,是化学变化,故⑤正确;
⑥工业制氧气,方法是先将空气降温加压液化,然后降压升温,先变成气体的是氮气,剩余的主要是氧气,过程是液化和气化,无新物质生成,故⑥错误;
⑦白磷有毒,红磷无毒,两者是不同的物质,白磷转化为红磷,是化学变化,故⑦正确;
⑧久置浓硝酸变黄发生反应:4HNO3$\frac{\underline{\;光照\;}}{\;}$2H2O+4NO2↑+O2↑,生成的二氧化氮溶解其中呈黄色,故⑧正确;
⑨16O与18O间的相互转化属于核反应,不是化学变化,故⑨错误;
故选B.
点评 本题考查了怎样判断化学变化,方法就是:看是否生成新物质,平时学习应多关注日常生活中的化学知识,难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题

| A. | 六星烷的化学式为C18H24 | |
| B. | 它们之间互为同系物 | |
| C. | 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体 互为同分异构体 | |
| D. | 星烷的一氯代物均只有2种,而三星烷的二氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75%的酒精溶液 | B. | 硝酸钠(固态) | C. | Fe(OH)3胶体 | D. | 豆浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
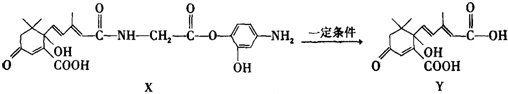
| A. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| D. | X结构中有2个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NaHSO4晶体中离子总数为2NA | |
| B. | 4.4g 14CO2含中子数为2.4NA | |
| C. | 0.3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| D. | 1 molFe在氧气中燃烧失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23.9% | B. | 11.0% | C. | 13.5mol/L | D. | 5.67mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )
在密闭容器中存在反应:2SO2(g)+O2(g)═2SO3(g)△H<0,某研究小组研究该反应后作出了如图所示曲线.下列分析正确的是( )| 选项 | Y的物理意义 | 甲、乙的物理意义 | 甲与乙的大小 |
| A | SO2的转率 | 温度 | 甲>乙 |
| B | SO2的体积分数 | 压强 | 甲>乙 |
| C | SO3的体积分数 | 温度 | 乙>甲 |
| D | SO2的转率 | 压强 | 乙>甲 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com