
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取少量上述漂白粉于试管中,先加入适量1mol•L-1盐酸溶解后,再把生成的气体通入新制澄清石灰水中. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则假设2或假设3成立. |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1mol•L-1 HCl溶液,再加入几滴品红溶液振荡. | 若品红溶液不褪色,则假设2成立; 若品红溶液褪色,则假设3成立. |
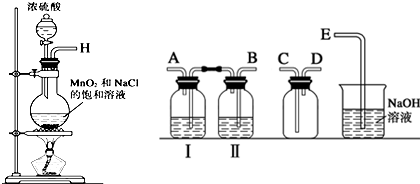
分析 (1)按照气体的制备、除杂、收集、尾气处理的步骤连接实验装置,制备氯气的实验中,要除去杂质氯化氢和水蒸汽,所以用到洗气装置,一般是长进短出,又因为是先除去混合气中的氯化氢,因此广口瓶Ⅱ中的试剂为饱和食盐水,氯气在饱和食盐水的溶解度较小;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,碳酸钙不溶于水,加入盐酸,次氯酸具有漂白性,可使品红褪色.
解答 解:(1)实验室制取氯气时,首先要制取氯气,然后通过饱和食盐水除去挥发出来的氯化氢气体,通过浓硫酸除去混入的水蒸气,这时得到了干燥、纯净的氯气,要用向下排空气法收集氯气,最后要吸收多余的氯气,注意防止倒吸,仪器连接为H→B→A→C→D→E,
故答案为:B;A;C; D;E; 饱和食盐水;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)①漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,则漂白粉未变质,只含Ca(ClO)2,漂白粉全部变质,只含CaCO3,漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3.
故答案为:CaCO3;
②可加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中,若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立;
向步骤①反应后的试管滴入1~2滴品红溶液,振荡,若品红褪色,则假设3成立;若品红不褪色,则假设2成立.
故答案为:
| 实验步骤 | 预期现象和结论 | |
| ① | 适量1mol/L盐酸,新制澄清石灰水中 | 澄清石灰水未见浑浊;澄清石灰水变浑浊 |
| ② | 几滴品红溶液振荡 | 品红溶液不褪色;品红溶液褪色. |
点评 本题易氯气为载体考查性质实验,侧重于学生的实验能力的考查,为高考常见题型和高频考点,题目难度中等,注意把握物质的性质以及实验原理.


科目:高中化学 来源: 题型:选择题
| A. | pH=12的NaOH溶液加水稀释100倍,溶液pH=10 | |
| B. | pH=5的盐酸溶液稀释1000倍,溶液的pH约等于7 | |
| C. | pH=2的 H2SO4与pH=12的NaOH溶液等体积混和,溶液pH=7 | |
| D. | pH=12的NH3•H2O与pH=2的HCl溶液等体积混和,混和液pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-CH2-CH2-OH | B. | Cl-CH2-CHO | C. | HCOOCH2Cl | D. | HO-CH2-CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
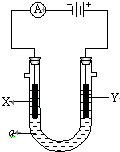 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
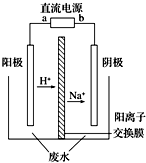 最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 电解过程中,阴极区消耗Na+ | |
| B. | 阳极反应为CH3CHO-2e-+2H+═CH3COOH+H2O | |
| C. | 电解的总反应方程式为2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3COOH+CH3CH2OH | |
| D. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下水溶液的pH:Na2CO3>Na2SO4 | |
| B. | 酸性:H2SO3>H2CO3 | |
| C. | CH4比NH3更稳定 | |
| D. | C与H2的化合价比N2与H2的化合更容易 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com