
����Ŀ��Na2CO3����Ҫ�Ļ���ԭ�ϣ���ҵ�ϲ���NH3��CO2��NaClΪԭ�����Ʊ���ij��ȤС����NH4HCO3�����滻NH3��CO2����������������ʵ����ģ���Ʊ�Na2CO3��

���������գ�
��1������1�У�Ϊ���Ʒ�Ӧ�¶���30��35�棬Ӧѡ�õļ��ȷ�ʽ��_______________��ʵ��ǰNH4HCO3��������____________����������ƣ�ĥ�ɷ�ĩ���Ҽ���ʱҪ���Ͻ��裬��Щ������Ŀ����_____________________________________________________________��
��2������3�У�ʹ�ñ���NaHCO3��Һϴ�Ӱ�ɫ�����ԭ����____________________________��
��3������4�У�����¯�ڷ����Ļ�ѧ��ӦΪ______________________________����д��ѧ����ʽ����
Ϊ�����Ʒ���ȣ���С�鰴�������̲�����

��4���жϲ���II�еμ�Ba(OH)2��Һ�Ƿ�����ķ�����___________________________________��
��5������Ʒ�����ʲ���Ba(OH)2��Ӧ����Na2CO3����������Ϊ____________��С���������λ����
��6������Ʒ������������NaHCO3��NaCl�е�һ�ֻ����֣������ȷ����Ʒ���Ƿ���NaCl�����ʵ�鷽��_________________________________________________________________��
����ͬѧ��Ϊ����������ʵ�����ݾͿ����жϳ���Ʒ��һ������NaCl��������ʵ����飬�жϵ�������____________________________________________________________________________________��
���𰸡�ˮԡ���� �в� ʹ��Ӧ���ֽӴ� NaHCO3�����ڱ���NaHCO3��Һ�в����ܽ⣬����ϴ�ӿ��Լ��ٲ�Ʒ����ʧ 2NaHCO3![]() Na2CO3+H2O+CO2�� ���ã����ϲ���Һ�еμ�Ba(OH)2��Һ��������������� 0.98 ȡ��������Ʒ����ˮ�������еμ������������ݲ������ٵμ����������а�ɫ�������ɣ�����NaCl�� ͨ��BaCO3����������������Ʒ�к�Na2CO3��Na2CO3��NaHCO3��������С��0.530g����������һ����NaCl��
Na2CO3+H2O+CO2�� ���ã����ϲ���Һ�еμ�Ba(OH)2��Һ��������������� 0.98 ȡ��������Ʒ����ˮ�������еμ������������ݲ������ٵμ����������а�ɫ�������ɣ�����NaCl�� ͨ��BaCO3����������������Ʒ�к�Na2CO3��Na2CO3��NaHCO3��������С��0.530g����������һ����NaCl��
��������
(1)��Ӧ�¶���30��35�棬С��100��ʱ�ɲ���ˮԡ���ȣ��������ͨ�����в���
(2)̼�������ܽ��С��̼����泥����ɫ����ΪNaHCO3���ñ���̼��������Һ�ɼ���̼�����Ƶ���ʧ��
(3)����4Ϊ̼�����Ƽ��ȷֽ�����̼���ơ�������̼��ˮ��
(4)ȡ�����ϲ���Һ����������������Һ�������Ƿ����ɳ���������
(5)���ݹ�ϵʽBa(OH)2��BaCO3��Na2CO3���㣻
(6)���ȼ������ϡ���ᣬȻ�������������Һ�������Ƿ��г������ɿɼ����Ƿ����Ȼ��ƣ�
�����ü�ֵ������0.530g��ȫΪ̼���ƻ�̼�����ƣ����������̼�ᱵ�������������ݼ�����������
(1)����1�У�Ϊ���Ʒ�Ӧ�¶���30��35�棬Ϊ�˵õ����ȶ����¶ȣ����Բ���ˮԡ���ȵķ�����ʵ������NH4HCO3���������в��н��У��������Ͳ��Ͻ��裬������ʹ��Ӧ���ֽӴ����ӿ췴Ӧ���ʣ�
(2)NaHCO3���ܽ��С��NH4HCO3���õ��İ�ɫ����ΪNaHCO3������NaHCO3�����ڱ���NaHCO3��Һ�в����ܽ⣬Ϊ�˳�ȥ̼�����Ʊ��������ʣ��Ҽ���̼�����Ƶ���ʧ�����ñ���NaHCO3��Һϴ�ӣ�
(3)��ɫ����Ϊ̼�����ƣ�̼�����Ʋ��ȶ������ȷֽ�����̼���ƣ���Ӧ����ʽΪ��2NaHCO3![]() Na2CO3+CO2��H2O��
Na2CO3+CO2��H2O��
(4)�������еμ�Ba(OH)2��Һ�Ƿ�����ķ����ǣ����ã����ϲ���Һ�еμ�Ba(OH)2��Һ�����������������
(5)n(BaCO3)��![]() ��0.00490mol�����ݹ�ϵʽBa(OH)2��BaCO3��Na2CO3��֪��n(Na2CO3)��n(BaCO3)��0.00490mol����Ʒ��Na2CO3����������Ϊ��
��0.00490mol�����ݹ�ϵʽBa(OH)2��BaCO3��Na2CO3��֪��n(Na2CO3)��n(BaCO3)��0.00490mol����Ʒ��Na2CO3����������Ϊ��![]() ��0.98��
��0.98��
(6)��ȷ����Ʒ���Ƿ���NaCl��ʵ�鷽��Ϊ��ȡ��������Ʒ����ˮ�������еμ�ϡ���������ٲ������ݣ��ٵμ����������а�ɫ�������ɣ�����NaCl��������
����0.530g��ȫΪNa2CO3������̼ԭ���غ�n(BaCO3)��n(Na2CO3)��![]() ��0.005mol��0.00490mol������0.530g��ȫΪNaHCO3������̼ԭ���غ�n(BaCO3)��n(Na2CO3)��
��0.005mol��0.00490mol������0.530g��ȫΪNaHCO3������̼ԭ���غ�n(BaCO3)��n(Na2CO3)��![]() ��0.0063mol��0.00490mol��������Ʒ��һ������NaCl��
��0.0063mol��0.00490mol��������Ʒ��һ������NaCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯�����з����Ļ�����Ӧ֮һ���£�FeO��s��+CO��g��![]() Fe��s��+CO2��g��������Ӧ�����ȷ�Ӧ������ƽ�ⳣ���ɱ�ʾΪK=
Fe��s��+CO2��g��������Ӧ�����ȷ�Ӧ������ƽ�ⳣ���ɱ�ʾΪK=![]() ����֪1100��ʱK=0.263
����֪1100��ʱK=0.263
��1���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��¯��CO2��CO�������ֵ________��ƽ�ⳣ��Kֵ___________ ��ѡ�������С�����䡱����
��2��1100��ʱ��ø�¯��c��CO2��=0.025mol��L��1��c��CO��=0.1mol��L��1������������£��÷�Ӧ�Ƿ��ڻ�ѧƽ��״̬_________ ��ѡ��ǡ�������ʱ����ѧ��Ӧ�����Ǧԣ�����_______ �ԣ��棩��ѡ����ڡ���С�ڡ����ڡ�������ԭ����____________��
��3����Դ����������������ٵ��ش���⣬�״���δ����Ҫ����ɫ��Դ֮һ����CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
��.CH4��g����H2O��g��=CO��g����3H2��g����H����206.0 kJ/mol
��.CO��g����2H2��g��=CH3OH��g����H����129.0 kJ/mol
CH4��g����H2O��g����Ӧ����CH3OH��g����H2��g�����Ȼ�ѧ����ʽ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ�ã���ش�

��1�������з�����Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��2�����е�ʵ������Ϊʯ����Һ____________����ʵ��֤��SO2����____________�����ʡ�
��3�����е�Ʒ����Һ________��֤��SO2��________�ԡ�
��4�����е�ʵ��������________________________��֤��SO2��____________�ԡ�
��5�����е�ʵ��������______��֤��SO2��______�ԡ�
��6������������____________����Ӧ�Ļ�ѧ����ʽΪ____________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������98%Ũ����(���ʵ���Ũ��Ϊ18.4mol/L)������ˮ����250mL���ʵ���Ũ��Ϊ2mol��L��1��ϡ���ᡣ
(1)��ѧ����Ҫ��ȡ����Ũ����____________mL(��������ȷ��0.1)��
(2)ȡ�ø�Ũ����ʱ������������������ȡ��Һ������ٶ��仯����________________��
A.��Һ��H2SO4�����ʵ��� B.��Һ���ܶ� C.��Һ��Ũ��
(3)ϡ��Ũ����IJ�����_________________��
(4)�����ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿(��ƫ�ߡ�ƫ�ͻ���Ӱ��)
a.Ũ����ϡ�ͺ�δ����ȴ������ת�Ƶ�����ƿ�С�________________
b.δϴ���ձ��Ͳ�������_______________
c.���ݺ���ҡ�ȡ����ã�����Һ���½���______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����Ԫ�ؿ��γ��������������ʡ�
(1)��ͼ��ʾijЩ�����ӵ�ģ�ͣ�
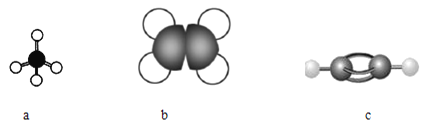
��д��a���ӵĿռ乹��______��
��c�����е�һ����ԭ�ӱ�![]() ��ȡ��������ʹ�ֱ�ߵ�ԭ�������______����
��ȡ��������ʹ�ֱ�ߵ�ԭ�������______����
��ȡ���������������������ȼ�գ�������������______(�����ʽ)��
��25����101kPaʱ��ȡa��b��c��ɵĻ����32mL�������������ϲ���ȫȼ�գ���ȥˮ�������ָ���ԭ�����¶Ⱥ�ѹǿ�������������С��56mL��ԭ�������c���������Ϊ______��
(2)ijϩ���Ľṹ��ʽ������ʾ��
![]()
����ϵͳ�������Ը�����![]() �ļӳɲ���������______���üӳɲ��������ȡ������______�֡�
�ļӳɲ���������______���üӳɲ��������ȡ������______�֡�
�ڸ�ϩ�����ԼӾ����ɸ߷��ӣ�д���ø߾���Ľṹ��ʽ______����ϩ����������ϩ��1:1������Ӧ�γ�һ�ֻ�״�������д���û�״������ļ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¢١�������װ��50mL��������Ͳ���ֱ��ȡ10mLH2O��10mL15%��NaOH��Һ����ͼ��ʾ����������ã�������Ͳ��������Һ�����������

A | B | C | D | |
��Ͳ�� | ����ɫ | ��Ư���� | ������ | ��Cl2���� |
��Ͳ�� | ����ɫ | ��Ư���� | �ʼ��� | ��Cl2���� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڶ������ϻ���ƽ��������ķ�Ӧ�ɱ�ʾΪ����2NH4ClO4��N2��+Cl2��+2O2��+4H2O����4Al(s)+3O2(g)��2Al2O3(s)+QkJ��Q>0�������������գ�
��1����дH2O�ĵ���ʽ____________________��Clԭ�Ӻ�����______�ֲ�ͬ�����ĵ��ӡ�
��2�������������γɵľ����У�ֻ����һ����������������________������ţ���
a. N2 b. Al2O3 c. H2O d. NH4ClO4
��3��N2��O2������H2��Ӧ�������߷�Ӧ��������ϴ�������ԭ�ٴӷ��Ӷϼ��Ƕȿ���N2���Ӹ��Ѷϼ���ԭ����_________________________________���ڴ�ԭ�ӳɼ��Ƕȿ���Oԭ�Ӹ�����Hԭ�ӽ�ϣ�ԭ����______________________________________________��
��4����Ӧ���У�����������_______������1molN2ʱ����Ӧ��ת��_______NA���ӡ���ζ��ֽ⣬NH4Cl��NH4HCO4�����ȷֽ�õ�NH3����Ӧ���ᣬ��NH4NO3����κ�NH4ClO4�ֽ����ƣ�һ�����õ���Ӧ�ᣬ�Ҳ������ΪN2��NO�����ʡ��������ͬ������ȷֽ������ڲ���Ŀ���ԭ��__________��
��5�����������仯ʾ��ͼ���뷴Ӧ���������ֵ�������ϵƥ�����________������ţ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����˵������ȷ����
A. ���ʵ���Ũ����ͬ��NaOH��Һ�Ͱ�ˮ��c(Na+)��c(NH4+)
B. ���ʵ���Ũ����ͬ������ʹ�����Һ��ǰ��c(OH-)��С
C. ����ͬ������ͬ���ʵ���Ũ�ȵ�NaOH��Һ�ʹ�����Һ��Ϻ�ʼ��ԣ�˵���������������
D. pH=3�������pH=11�İ�ˮ��Ϻ�pH��7��˵����ˮ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ�Ž��з���Ԫ��������150���ꡣ�Ž��з�Ԥ���˺ܶ�δ֪Ԫ�أ���������һ�֣���ҵ���þ��������Ҫ�ɷ�ΪGeS2����ȡ�ߴ����࣬�乤��������ͼ��ʾ����ش�
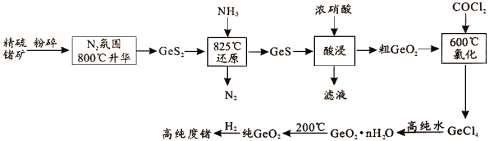
��1������Ԫ�����ڱ��е�λ����__________��
��2��800�棬��N2��Χ��ʹ�������������Ŀ����______________��
��3�����ʱGe��SԪ�ؾ������������̬��д���÷�Ӧ�����ӷ���ʽ____�����ʱ�¶Ȳ��ܹ��ߵ�ԭ����_____
��4��GeCl4��ˮ������GeO2��nH2O���˹��̻�ѧ����ʽΪ_____���¶ȶ�GeCl4ˮ���ʵ�Ӱ����ͼ��ʾ��Ϊ���ˮ���ʣ�ʵ��ʱ�ɲ�ȡ�Ĵ�ʩΪ______������ţ���

A����ˮԡ
B������ˮԡ
C��49��ˮԡ
��5�����ж�25��ʱ0.1mol��L-1NaHGeO3��ҺpH________������������������������7��������____����֪25��ʱ��H2GeO3��Ka1=1.7��10-9��Ka2=1.9��10-13����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com