

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等),焙烧除去碳和有机物,水钴矿中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入过氧化氢可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到滤渣1为Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液Ⅰ主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,
(1)一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等),焙烧除去碳及有机物;浸钴过程中Co3+转化为Co2+,是亚硫酸钠被氧化生成硫酸钠;
(2)加入H2O2的目的是氧化亚铁离子生成铁离子,调节溶液PH除去铁离子和铝离子;
(3)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积计算;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,加入萃取剂的作用是除去Mn2+,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀;
(5)mg含钴废料中含Co2O3质量分数为a%,则钴元素的物质的量为$\frac{m×a%×2}{166}$mol,钴元素质量守恒计算得到.
解答 解:(1)一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等),焙烧除去碳及有机物,亚硫酸钠具有还原性,能还原氧化性离子Co3+,反应为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
故答案为:除去碳和有机物; 2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(2)过氧化氢的作用是:将浸出液中Fe2+氧化为Fe3+,加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀Al(OH)3、Fe(OH)3;
故答案为:将 Fe2+氧化为 Fe3+;Al(OH)3、Fe(OH)3;
(3)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积计算,c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7,若所得滤液中c(Ca2+)=1.0×10-3mol•L-1,则滤液中c(Mg2+)=7.0×10-4 mol•L-1
故答案为:7.0×10-6 mol•L-1;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,滤液Ⅱ中加入萃取剂的作用是除去Mn2+,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
故答案为:除去Mn2+;3.0~3.5;
(5)mg含钴废料中含Co2O3质量分数为a%,则钴元素的物质的量为$\frac{m×a%×2}{166}$mol,钴元素质量守恒则,草酸钴(CoC2O4)的质量为$\frac{m×a%×2}{166}$mol×147g/mol=$\frac{147ma%}{83}$=1.77×10-2ma;
故答案为:$\frac{147ma%}{83}$或 1.77×10-2ma;
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解、氧化还原反应等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:解答题
 ,所含化学键的类型有离子键、共价键.
,所含化学键的类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→消去→取代 | B. | 消去→加成→水解? | C. | 取代→消去→加成 | D. | 消去→加成→取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
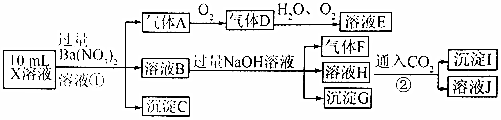
| A. | X 中肯定存在 Fe2+、A13+、NH4+、SO42- | |
| B. | X中不能确定是否存在的离子是Al3+和Cl- | |
| C. | 溶液E和气体F发生反应,生成物为盐类 | |
| D. | 气体A是NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com