
【题目】下列关于实验基本操作的叙述不正确的是( )
A.使用分液漏斗和容量瓶时,首先要查仪器是否漏液
B.蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生暴沸
C.将浓硫酸倒入盛水的量筒中稀释成稀硫酸
D.用蒸发皿进行加热蒸发时,不需垫石棉网可直接进行加热
科目:高中化学 来源: 题型:
【题目】某溶液仅含![]() 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为![]() .若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是
.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是
A. 若向该溶液中加入过量的稀硫酸和![]() 溶液,溶液显血红色
溶液,溶液显血红色
B. 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C. 该溶液中一定有![]()
D. 若向该溶液中加入足量的![]() 溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体甲为非金属,I、F均为常见的金属,E为气体单质;固体乙为一种红棕色固体;G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液.A在常温下为气态,与氧气完全反应时的体积比是![]() .W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为
.W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为![]() .各物质有如下图所示的转化关系(部分反应的产物未全部表示).试回答下列题:
.各物质有如下图所示的转化关系(部分反应的产物未全部表示).试回答下列题:

(1)B的电子式为______,固体甲、乙的化学式分别是______、______;
(2)上述转化中,①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() 其中属于置换反应的是(填序号)______;
其中属于置换反应的是(填序号)______;
(3)写出W和水反应的化学方程式______,![]() 和
和![]() 溶液反应的离子方程式______.
溶液反应的离子方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 0.2mol/L的NaHCO3溶液中: c(Na+)>c(HCO3-)>c(OH-)>c(H+)
B. 叠氮酸(HN3)与醋酸酸性相近,0.1mol/LNaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-)
D. 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)= c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A. 向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
B. 向带有氧化膜的铝片中加入盐酸
C. 向漂白粉溶液中通入过量CO2
D. 向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程证明了海带中存在碘元素:

下列说法不正确的是
A. 步骤①需要将干海带放入蒸发皿中灼烧
B. 步骤②中发生反应的离子方程式为2I-+2H++H2O2=I2+2H2O
C. 步骤③操作后,观察到试管中的溶液变为蓝色,则可说明海带中含有碘元素
D. 若步骤②仅滴加稀硫酸后通入氧气,则步骤③操作后,试管中的溶液也变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
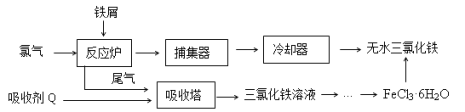
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸, 再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuⅠ)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。
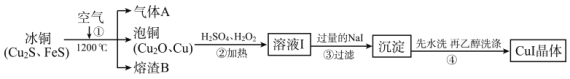
(1)FeS中S的化合价为_____________。
(2)步骤①中Cu2S被转化为Cu,同时有大气污染物A生成,相关化学反应方程式为_____________,熔渣B的主要成分为黑色磁性物质,其化学式为_____________。
(3)步骤②中H2O2的作用是_____________;步骤③中加入过量NaI涉及的主要离子反应方程式为_____________。
(4)步骤④用乙醇洗涤的优点是_____________;检验沉淀是否洗涤干净的方法是_____________。
(5)溶液I中通常含少量Fe(Ⅲ)。已知该工业条件下,Fe(OH)3的Ksp=1.0×10-38,据此分析除去Fe(Ⅲ)(即c(Fe3+)≤1.0×10-5mol/L)应调节pH不小于_____________(水的离子积以常温计)。
(6)准确称取 m g CuI样品,加入足量的Fe2(SO4)3溶液,发生反应为2CuⅠ+4Fe3+===2Cu2++4Fe2++I2,待样品完全反应后,用amol/L酸性KMnO4溶液滴定Fe(Ⅱ),消耗标准液的体积平均值为ⅴmL。样品中CuI的质量分数的计算表达式为_____________;如果滴定前,酸式滴定管没有用标准液润洗,CuI的质量分数_____________(填“偏低”、“偏高”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com