
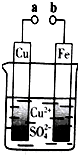
| A. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| B. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| C. | a和b不连接时,铁片上会有金属铜析出 | |
| D. | a和b用导线连接时,外电路中每通过0.1mol电子,铜的质量理论上增加3.2g |
分析 A、根据无论a和b是否连接,都会发生Fe+Cu2+=Fe2++Cu进行分析;
B、根据a和b用导线连接时,形成原电池,铜离子在正极得到电子进行分析;
C、根据a和b不连接时,铁与硫酸铜会发生置换反应进行分析;
D、根据电极反应式结合电子守恒来计算.
解答 解:A、无论a和b是否连接,都会发生Fe+Cu2+=Fe2++Cu,铁片均会溶解,溶液从蓝色逐渐变成浅绿色,故A正确;
B、a和b分别连接直流电源正、负极,电压足够大时,Cu2+向阴极移动,Cu2+向Fe电极移动,故B错误;
C、a和b不连接时,铁与硫酸铜会发生置换反应,铁片上会有金属铜析出,故C正确;
D、a和b用导线连接时,铜为正极,该电极的质量会增加,发生电极反应:Cu2++2e-=Cu,外电路中每通过0.1mol电子,析出金属铜0.05mol,质量是3.2g,故D正确.
故选:B.
点评 本题考查了原电池原理,明确正、负极的判断方法,电极反应类型,阴阳离子移动方向即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的产量是一个国家石油化工水平的重要标志,工业上主要来源于石油的裂解 | |
| B. | 甲醇也称木醇,无色易挥发液体,有毒.含有甲醇的工业酒精不可饮用 | |
| C. | 甲醛通常条件下是一种无色、有刺激性气味的液体,工业上可用于制取酚醛树脂等 | |
| D. | 苯酚又称石炭酸,无色晶体,有毒,可以用作杀菌消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 废电池需回收,主要是要利用电池外壳的金属材料 | |
| D. | 升高温度可降低活化能,增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ NH4+ SO42-Cl- | B. | Na+Mg2+ HCO3- NO3- | ||
| C. | K+ Na+ AlO2-Cl- | D. | Fe2+ K+NO3-Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
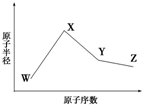 已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .c(Na+)=c(HB-)+2c(B2-)+c(OH-) | B. | .c(Na+)=0.1mol•L-1≥c(B2-) | ||
| C. | .c(H+)•c(OH-)=10-14 | D. | 此溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液一定含有CO32- | |
| B. | 无色溶液中加入 AgNO3溶液,有白色沉淀生成,则原溶液一定含有Cl- | |
| C. | 无色溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝,则原溶液中一定含有NH4+ | |
| D. | 无色溶液中加入BaCl2溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com