
【题目】下列关于热化学反应的描述中正确的是( )
A. 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含74.0 g Ca(OH)2的稀溶液与稀硫酸完全中和,放出57.3 kJ的热量
B. 已知N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1,将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1mol NH3(g),放出46.2kJ的热量
2NH3(g) △H=-92.4kJ·mol-1,将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1mol NH3(g),放出46.2kJ的热量
C. 2gH2完全燃烧生成液态水放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+1/2O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
【答案】B
【解析】
A.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,74.0gCa(OH)2的稀溶液与稀硫酸完全中和生成2mol水,应放出114.6kJ的热量,故A错误;
B.由N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1可知,完全反应生成2mol的NH3(g),放出92.4kJ的热量,所以将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1molNH3(g),放出46.2kJ的热量,故B正确;
2NH3(g) △H=-92.4kJ·mol-1可知,完全反应生成2mol的NH3(g),放出92.4kJ的热量,所以将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1molNH3(g),放出46.2kJ的热量,故B正确;
C.ΔH的单位为kJ·mol-1,所以氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,故C错误;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的化合物所放出的热量,甲醇燃烧生成的氢气不属于稳定的化合物,故D错误。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】新型抗溃疡药瑞巴匹特,可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
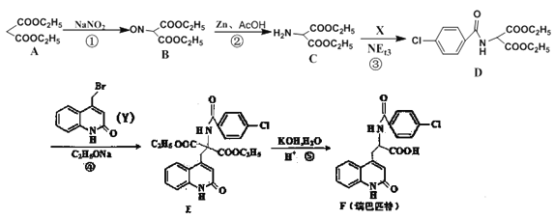
(1)A的化学名称为______________,C的核磁共振氢谱具有_________________组峰
(2)A与足量的NaOH溶液反应的化学方程式为______________
(3)化合物F中含氧官能团的名称为__________________,化合物F的分子式为_____________
(4)反应①~③中,属于取代反应的是__________________(填序号)
(5)C→D的转化中,生成的另一种产物为HCl,则C→D反应的化学方程式为__________
(6)已知Y中的溴原子被--OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:___________________
I.分子中含有一个苯环和一个五元环,且都是碳原子环
II.苯环上有两个取代基,且处于对位
III.能与NaHCO3溶液发生反应
(7)已知CH3CH2OH![]() CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图如下:HOCH2CH2CH2OH
的合成路线流程图如下:HOCH2CH2CH2OH![]() 物质X
物质X![]() 物质Y
物质Y![]()
![]() ,则物质X为__________,物质Y为____________
,则物质X为__________,物质Y为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+ 3B(g)![]() 2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
A.②③④①B.④③②①C.③④②①D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素。X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:

(1)写出下列元素符号:Y________Z ________W ________R __________
(2)写出下列化合物的电子式:乙__________ 丙____________
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式:_____________________
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质,请写出该反应的化学方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。已知:CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
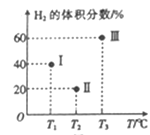
①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器___________。(填序号)
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg![]() 与温度(T)的关系如图所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图所示。下列说法正确的是_____(填字母)。
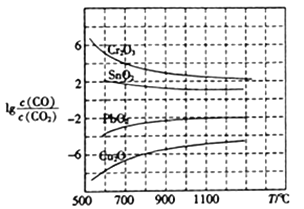
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
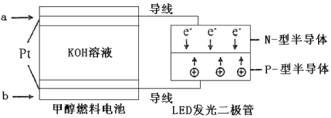
请写出加入(通入)a物质一极的电极反应式_________;每消耗6.4g甲醇转移的电子数为____。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可以用勒夏特列原理解释的是
A. 高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
B. 实验室采用排饱和食盐水的方法收集氯气(Cl2+H2O![]() HCl+HClO)
HCl+HClO)
C. 500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
D. FeCl3+3KSCN![]() Fe(SCN)3+3KCl, 增大KCl的浓度则溶液的颜色变浅
Fe(SCN)3+3KCl, 增大KCl的浓度则溶液的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是

A. 三种物质中B最不稳定,A最稳定
B. B→A反应的活化能为E1,反应B→C反应的ΔH=E4-E3
C. B→A反应与铝热反应一样都属于生成物的总能量高于反应物的总能量的放热反应
D. 反应B→C是放热反应, 反应A→C是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为:______________
(2)写出B、D化合物中官能团名称:
B中含官能团_____________;D中含官能团_________;
(3)写出反应的化学方程式
①___________________________________________ 反应类型:___________
②___________________________________________ 反应类型:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com