
分析 发生N2O4?2NO2,2s时NO2的浓度为0.02mol.L-1,生成NO2的物质的量为0.02mol/L×5L=0.1mol,
N2O4?2NO2,
开始 0.5 0
转化 0.05 0.1
2s 0.45 0.1
设达到平衡时设转化的N2O4为x,则
N2O4?2NO2,
开始 0.5 0
转化 x 2x
平衡 0.5-x 2x
60s时达到平衡,此时容器内的压强为开始时的1.6倍,
$\frac{0.5-x+2x}{0.5}=\frac{1.6}{1}$,
解得x=0.3mol,
结合转化率=$\frac{转化的量}{开始的量}$、物质的量比等于压强的比来解答.
解答 解:(1)2s时NO2的浓度为0.02mol.L-1,v(NO2)=$\frac{0.02mol/L}{2s}$=0.01mol•L-1•s-1,由反应速率之比等于化学计量数之比,则2s时用N2O4浓度变化表示的化学反应速率是0.005mol•L-1•s-1,故答案为:0.005mol•L-1•s-1;
(2)发生N2O4?2NO2,2s时NO2的浓度为0.02mol.L-1,生成NO2的物质的量为0.02mol/L×5L=0.1mol,
N2O4?2NO2,
开始 0.5 0
转化 0.05 0.1
2s 0.45 0.1
2s时,体系内的压强为开始时的$\frac{0.45mol+0.1mol}{0.5mol}$=1.1倍,此时N2O4的分解率为$\frac{0.05mol}{0.5mol}$×100%=10%,
故答案为:1.1; 10%;
(3)设达到平衡时设转化的N2O4为x,则
N2O4?2NO2,
开始 0.5 0
转化 x 2x
平衡 0.5-x 2x
60s时达到平衡,此时容器内的压强为开始时的1.6倍,
$\frac{0.5-x+2x}{0.5}=\frac{1.6}{1}$,
解得x=0.3mol,
达到平衡时,平衡混合物中N2O4的物质的量为0.5mol-0.3mol=0.2mol,
故答案为:0.2mol.
点评 本题考查化学平衡的计算,为高频考点,把握反应速率的计算、转化率计算、平衡三段法为解答的关键,侧重分析与计算能力的考查,注意物质的量与压强的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
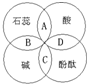 某同学在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系.图中A、B、C、D分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中不正确的是( )
某同学在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系.图中A、B、C、D分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中不正确的是( )| A. | 紫色 | B. | 蓝色 | C. | 红色 | D. | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
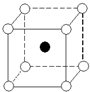 如图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子.已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子.已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为( )| A. | $\frac{2M}{{N}_{A}{a}^{3}}$g/cm3 | B. | $\frac{M}{2{N}_{A}{a}^{3}}$g/cm3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g/cm3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g/cm3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1、2 | B. | 3、4 | C. | 1、1 | D. | 3、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 电解装置如图所示,图中B装置盛有1L2mol•L-1的Na2SO4溶液,A装置盛有1L2mol•L-1的AgNO3溶液,通电后,湿润的淀粉KI试纸的C端变蓝色,电解一段时间后,试回答:
电解装置如图所示,图中B装置盛有1L2mol•L-1的Na2SO4溶液,A装置盛有1L2mol•L-1的AgNO3溶液,通电后,湿润的淀粉KI试纸的C端变蓝色,电解一段时间后,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
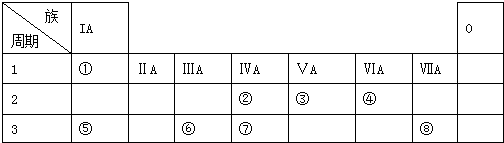
 .
.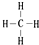 .
.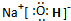 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com