
| A. | 自然界中不存在游离态的硫,且S可溶于CS2 | |
| B. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| C. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 | |
| D. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
分析 A.S易溶于CS2,火山口存在游离态的硫;
B.二氧化硫与水反应生成亚硫酸,亚硫酸为弱酸;
C.浓硫酸具有酸性和强氧化性,只能用于干燥酸性、中性且与浓硫酸不发生氧化还原反应的气体;
D.铜和浓硫酸加热发生反应.
解答 解:A.自然界中存在游离态的硫,如火山口存在游离态的硫,且S易溶于CS2,故A错误;
B.二氧化硫与水反应生成亚硫酸,亚硫酸为弱酸,三氧化硫与水反应生成硫酸,硫酸为强酸,故B错误;
C.SO2、Cl2等为酸性气体,CO为中性气体,且都与浓硫酸不发生氧化还原反应,可用浓硫酸来干燥,故C正确;
D.铜和浓硫酸常温下不能发生反应,加热发生反应,不是铜的钝化,故D错误;
故选C.
点评 本题考查含硫物质的性质,侧重二氧化硫、浓硫酸性质的考查,注意性质与现象、用途的关系即可解答,注重基础知识的训练,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 将Zn片放入CuSO4溶液 | D. | 铝与MnO2发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
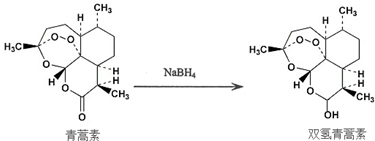
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 6个 | C. | 8个 | D. | 12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
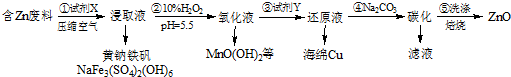
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
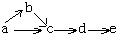 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价| A. | N2 | B. | C12 | C. | Si | D. | C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com