
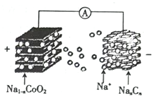
 室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:
室温钠离子电池具有资源丰富,成本低,能量转换效率高、寿命等优势.一种用碳基材料(NaxCn)作负极的可充电钠离子电池的瓜原理如下:| A. | 充电时,Na+向正极移动 | |
| B. | 放电时,负极的电极反应式为NaxCn-xe-=xNa++Cn | |
| C. | 充电时,阴极质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-=Na1-xCoO2+xNa+ |
分析 A、充电时,是电解池的工作原理,电解质里的阳离子移向阴极,电池的负极和电源的负极相连;
B、放电时,是原电池工作原理,负极上发生失电子的氧化反应;
C、充电时,是电解池的工作原理,在阴极上是阳离子发生得电子的还原反应;
D、充电时,是电解池的工作原理,在阳极上发生失电子的氧化反应.
解答 解:A、充电时,是电解池的工作原理,电解质里的阳离子移向阴极,电池的负极和电源的负极相连,即Na+向负极移动,故A错误;
B、放电时,是原电池工作原理,负极上发生失电子的氧化反应,电极反应式为NaxCn-xe-=xNa++Cn,故B正确;
C、充电时,是电解池的工作原理,在阴极上是阳离子发生得电子的还原反应,和负极反应相反,电极质量不会减小,故C错误;
D、充电时,是电解池的工作原理,在阳极上发生失电子的氧化反应NaCoO2-xe-=Na1-xCoO2+xNa+,故D正确.
故选AC.
点评 本题考查原电池和电解池的工作原理以及电极反应式的书写知识,属于综合电化学知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
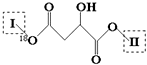 (其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
(其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
 .
. .
.
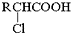 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH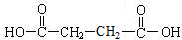 .
.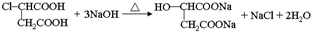 .
.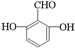 、
、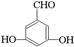 、
、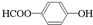 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B ,C
,C ,D
,D .它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3+H2O═H2SO4 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | AgNO3+HCl═AgCl↓+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -386kJ•mol-1 | B. | +386kJ•mol-1 | C. | -746kJ•mol-1 | D. | +746kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com