
现有物质的量浓度为0.1 mol/L的盐酸和0.1 mol/L的氨水,下列说法中正确的是( )
A.用湿润的pH试纸测定两种溶液的pH时,氨水的误差更大
B.若混合后溶液恰好呈中性时:c(Cl-)= c(NH4+)+ c(NH3·H2O)
C.两溶液等体积混合时,充分反应后:c(Cl-)> c(NH4+)> c(OH-)> c(H+)
D.恰好反应呈中性时,所需氨水的体积大于盐酸的体积
科目:高中化学 来源: 题型:
| c(H+) | c(OH-) |
查看答案和解析>>
科目:高中化学 来源:吉林省长春市十一中2012届高三上学期期中考试化学试题 题型:013
|
现有物质的量浓度为0.1 mol·L-1的下列五种物质的水溶液: ①HCl; ②H2SO4; ③CH3COOH; ④NH4Cl; ⑤NaOH, 其溶液中由水电离出C(H+)的大小关系是 | |
| [ ] | |
A. |
④>③>①=⑤>② |
B. |
①=②>③>④>⑤ |
C. |
③>①>②>④>⑤ |
D. |
③>④>①>⑤>② |
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
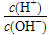 。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。
。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com