
已知强酸与强碱在稀溶液里反应的中和热可表示为
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 对下列反应:
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:填空题
(10分)Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 = 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn == Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。
查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
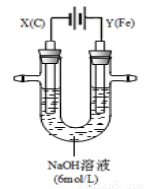
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH- = FeO42-+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
科学家宣布发现了铝的“超级原子”结构——Al13和Al14。已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期第二次教学质检化学试卷(解析版) 题型:选择题
向30mL 1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为
A.3mL B.7.5mL C.15mL D.17.5mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)  2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
A.平衡常数K值越大,X的转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市高三9月月考化学试卷(解析版) 题型:实验题
(本题共18分)配制480 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________等。
(2)计算、称量:需称量NaOH固体的质量为________。
(3)溶解、冷却,该步实验中需要使用玻璃棒,作用是___________________。
(4)转移、洗涤。洗涤烧杯2~3次是为了______________________________。
(5)定容、摇匀。定容的具体操作是___________________________________。
(6)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,偏低的是 ,无影响的是 (填字母序号)。
A、容量瓶洗净后未烘干;
B、在溶解过程中有少量液体溅出烧杯外
C、定容时俯视刻度线;
D、将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
E、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:填空题
(14分)在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H__________0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是__________。
A.缩小容器容积 B.及时分离出Y、Z C.使用合理的催化剂 D.升高体系温度
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:___________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南华侨中学高二上会考模拟化学试卷(解析版) 题型:实验题
(10分)某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验。(A中发生反应的化学方程式为:MnO2 + 4HCl(浓) ====MnCl2 + Cl2↑ + 2H2O)
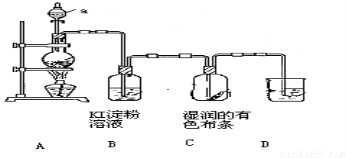
【实验探究】
(1)装置A中,仪器a的名称是 。
(2)装置B中无色溶液将变为 色,该反应的化学方程式是 。
(3)装置C中湿润的有色布条 (填“褪色”或“不褪色”),其原因是氯气与水反应生成了 (填化学式)
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放 溶液。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省福安市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关试剂的保存方法正确的是
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中
A.①③⑤ B.②③⑤ C.②④⑤ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com