
下列叙述中错误的是( )
A.原子半径 Na>Si>Cl
B.金属性 Na>Mg>Al
C.稳定性 SiH4<HCl<H2S
D.酸性 H3PO4<H2SO4<HClO4
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.共价键只有方向性
B.离子晶体中只存在阴阳离子间的静电吸引力
C.Na2O2中阴阳离子个数比为1:2
D.化学式CO2、SiO2、NaCl、CaH2都可以表示分子
查看答案和解析>>
科目:高中化学 来源: 题型:
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为 ( )。
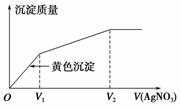
A.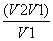 B.
B.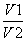
C.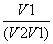 D.
D.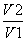
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
已知:两种成键元素间电负性差值大于1.7时,形成离子键,两种成键元素间电负性差值小于1.7时,形成共价键。
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是_______________
________________________________________________________________________。
(2)判断下列物质是离子化合物还是共价化合物?
Mg3N2 BeCl2 AlCl3 SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )。
A.含有离子键的晶体一定是离子晶体
B.离子晶体中一定不含共价键
C.Na2O和SiO2的晶体中都不存在单个分子
D.干冰与氖晶体熔化时克服的微粒间的作用力的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨基酸可发生如下反应:RCHNH2COOH+HNO2—→RCHOHCOOH+N2↑+H2O
且已知:D、E的相对分子质量分别为162和144,可发生如下物质转化关系,如下图所示:
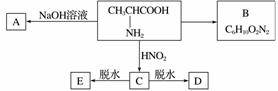
(1)写出B、D的结构简式:B____________,D_________________________________。
(2)写出C→E的化学方程式:______________________________________________。
(3)写出C→D的化学方程式:________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com