
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7)。
(1)用离子方程式表示该溶液中存在的三个平衡体系___、___、__。
(2)溶液中各离子的物质的量浓度由大到小顺序为___。
(3)溶液中粒子中浓度为0.1mol/L的是___,浓度为0.05mol/L的是__。
(4)物质的量之和为0.lmol的两种粒子是___与___。
【答案】CH3COOH![]() CH3COO-+H+ CH3COO-+H2O
CH3COO-+H+ CH3COO-+H2O![]() CH3COOH+OH- H2O
CH3COOH+OH- H2O![]() H++OH- c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-) Na+ Cl- CH3COOH CH3COO-
H++OH- c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-) Na+ Cl- CH3COOH CH3COO-
【解析】
0.1molCH3COONa和0.05molHCl充分反应得到物质的量均为0.05mol的NaCl、CH3COOH和CH3COONa的混合溶液,溶液的体积为1L,NaCl、CH3COOH和CH3COONa的物质的量浓度均为0.05mol/L,据此分析解答问题。
(1)该溶液中存在:CH3COOH的电离平衡,电离方程式为CH3COOH![]() CH3COO-+H+;CH3COONa的水解平衡,CH3COO-水解的离子方程式为CH3COO-+H2O
CH3COO-+H+;CH3COONa的水解平衡,CH3COO-水解的离子方程式为CH3COO-+H2O![]() CH3COOH+OH-;水的电离平衡:H2O
CH3COOH+OH-;水的电离平衡:H2O![]() H++OH-;故答案为:CH3COOH
H++OH-;故答案为:CH3COOH![]() CH3COO-+H+;CH3COO-+H2O
CH3COO-+H+;CH3COO-+H2O![]() CH3COOH+OH-;H2O
CH3COOH+OH-;H2O![]() H++OH-;
H++OH-;
(2)由于溶液的pH<7,说明CH3COOH的电离程度大于CH3COO-的水解程度,则溶液中离子物质的量浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-),故答案为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)>c(OH-);
(3)溶液中粒子浓度为0.1mol/L的是Na+,浓度为0.05mol/L的是Cl-。故答案为:Na+;Cl-;
(4)根据物料守恒,物质的量之和为0.1mol的是CH3COOH和CH3COO-,故答案为:CH3COOH;CH3COO-。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是
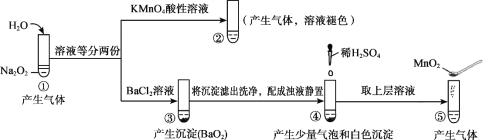
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物X、Y、Z、M的相互转化关系如图所示(部分反应条件、部分反应中的H.,O已略去)。X、Y、Z均含有同一种元素。下列说法正确的是
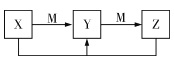
A. 若X是氢氧化钠,则M不一定为CO2
B. 若Y具有两性,则M的溶液只可能显碱性
C. 若Z是导致酸雨的主要气体,则X一定是H2S
D. 若M是用途最广的金属,加热蒸干Y的溶液一定能得到Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,用pH传感器进行数字化实验,将VlmL0.1mol/L的AOH溶液与V2mL0.1mol/L的HB溶液按V1+V2=100mL混合,测得V1、V2与混合液pH关系如图(生成的AB可溶于水)。下列叙述正确的是

A.曲线I表示强酸HB
B.K点溶液中存在2c(A+)+c(H+)=2c(B-)+c(OH-)
C.电离平衡常数Ka(HB)>Kb(AOH)
D.从L点到M点,水的电离程度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】历史上金、银、铜主要是作为货币金属或装饰品被应用。试回答下列问题:
(1)Ag在元素周期表中的位置_________,Ag+的价电子排布式为_________。
(2)冶金工业上,提取金的原理是2[Au(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
(3)已知基态铜的部分电离能如表所示:
电离能/kJ/mol | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
由表格数据知,I2(Cu)远远大于I1(Cu),其原因是_________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到结构如图所示配合物。
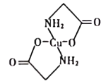
①配合物中碳原子的轨道杂化类型为_________。
②1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________mol。
(5)某Q原子的外围电子排布式为3s23p5,铜与Q形成化合物的晶胞如图所示(白球代表Q原子)。每个铜原子周围距离最近的铜原子数目为_________个;该晶体的化学式为_________。已知该晶体的密度为ρg·cm-3,晶体的摩尔质量为Mg/mol,阿伏伽德罗常数的值为NA,则该晶体中铜原子和Q原子之问的最短距离为_________pm(1pm=10-12m,只写计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入气体X | 产生白色沉淀 | X一定是氧化性气体 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | 向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中 | 产生白色浑浊 | 酸性:醋酸>碳酸>苯酚 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用PCl5作为制造乙酰纤维素的催化剂,也常用于手性药品的研发,在材料,医药工业得到了广泛应用,请回答下列问题:
(1)PCl5在固态是离子化合物,相对式量为417,其阳离子为![]() ,则阴离子的化学式为_______。
,则阴离子的化学式为_______。
(2)已知: P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol
Cl2(g) = PCl3(g) H= -306 KJ/mol
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol
则反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=______kJ/mol。
(3)温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,容器中发生反应:PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 0 | 0.12 | 0.17 | 0.2 | 0.2 |
①反应在前10min的平均速率v(PCl5)=_______;
②不能表明该反应达到平衡状态的是:____ (选填序号);
a.容器的总压强不再改变
b.混合气体的平均相对分子质量不变
c.v正(PCl3)等于v逆(Cl2)
d.混合气体的密度不变
e.PCl5的质量不再变化
③要提高上述反应的转化率,可采取的措施有(至少两种)___________;
④该温度下,反应PCl5(g)PCl3(g) + Cl2(g)的平衡常数Kp=2.25×105(Kp为压强平衡常数,Kp=![]() )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
(4)在热水中,五氯化磷完全水解,生成磷酸和盐酸。若将0.01molPCl5投入热水中配成lL溶液,再逐滴加入AgNO3溶液,先产生的沉淀是_____。 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学(或离子)方程式中,不能正确表达反应颜色变化的是
A.电解饱和食盐水产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.红热木炭遇浓硝酸产生红棕色气体:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D.向Ca(ClO)2溶液中通入少量SO2,出现白色沉淀SO2+Ca2++3ClO+H2O=CaSO4↓+2HClO+Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com