
分析 (1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的和缺少的仪器;
(2)根据溶液稀释定律C浓V浓=C稀V稀来计算需要浓硫酸体积;
(3)依据稀释浓溶液中玻璃棒起搅拌作用,移液时玻璃棒⑦引流作用解答;
(4)配制一定物质的量浓度溶液一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,据此排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有玻璃棒、烧杯、胶头滴管、量筒和500mL容量瓶,故不需要的仪器为⑤,还缺少的是500mL容量瓶,
故答案为:⑤;500mL容量瓶;
(2)设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=0.2mol/L×500mL,解得V=5.4mL;
故答案为:5.4;
(3)稀释浓溶液中玻璃棒起搅拌作用,移液时玻璃棒起引流作用;
故答案为:搅拌;引流;
(4)配制一定物质的量浓度溶液一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,所以:正确的操作顺序为:②→①→③→⑧→⑤→⑥→⑦→④;
故答案为:⑧⑤⑥⑦;
(5)①定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故选;
②未冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故不选;
③容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故选;
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故选;
⑥用量筒量取所需浓溶液时,仰视刻度,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故不选;
故选:①④⑤.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第ⅤA族 | B. | 第四周期第ⅤA族 | C. | 第五周期第ⅢA族 | D. | 第四周期第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4升的H2O含有的水分子数为NA | |
| B. | 标况下,11.2升CCl4中含有的Cl原子数为2NA | |
| C. | 17克NH3中含有的电子总数为10NA | |
| D. | 0.5mol/L的H2SO4溶液中含有的H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 得到2.54g沉淀时,加入NaOH溶液的体积是600L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +HCl
+HCl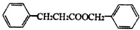 ;检验M中官能团的试剂是银氨溶液或新制备氢氧化铜浊液.
;检验M中官能团的试剂是银氨溶液或新制备氢氧化铜浊液.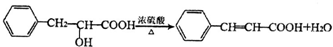 ,
, .
.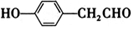 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com