
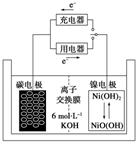
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时电池正极的电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时K+移向负极 | |
| C. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| D. | 该电池充电时将碳电极与电源的正极相连 |
分析 A.放电时,正极上NiO(OH)得电子发生还原反应;
B.放电时,电解质溶液中阳离子向正极移动;
C.放电时,负极上氢气失电子发生氧化反应;
D.该电池充电时,碳电极与电源的负极相连.
解答 解:A.放电时,正极上NiO(OH)得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,故A正确;
B.放电时,该电池为原电池,电解质溶液中阳离子向正极移动,所以钾离子向正极移动,故B错误;
C.放电时,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,故C错误;
D.该电池充电时,碳电极附近物质要恢复原状,则应该得电子发生还原反应,所以碳电极作阴极,应该与电源的负极相连,故D错误;
故选:A.
点评 本题考查了原电池和电解池原理,明确正负极上发生的电极反应及阴阳离子的移动方向即可解答,易错选项是D,注意结合电解原理确定与原电池哪个电极相连,为易错点.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
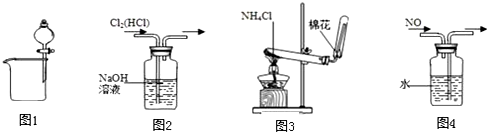
| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响 | |
| B. | 图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响 | |
| C. | 图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH= CO2↑+H2O+2CH3COO- | 错误,碳酸钙是难溶于水,不应写成离子形式 |
| B | 甲醛和足量银氨溶液充分反应 | HCHO+2Ag(NH3)2++2OH- $\frac{\underline{\;\;△\;\;}}{\;}$HCOO-+NH${\;}_{4}^{+}$+2Ag↓+H2O | 正确 |
| C | NaHSO3溶液的水解 | HSO3-+H2O?SO32-+H3O+ | 错误,水解方程式写成了电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,Fe2+与Br-的物质的量之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2CO3、BaCl2、HCl | B. | Na2CO3、BaCl2、HCl、NaOH | ||
| C. | BaCl2、HCl、NaOH、Na2CO3 | D. | NaOH、BaCl2、Na2CO3、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是物质的数量单位 | |
| B. | 氢气的摩尔质量是2g | |
| C. | 1mol OH-的质量是17g | |
| D. | 气体摩尔体积就是1mol气体所占的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和甲烷混合气体中的氢原子数一定大于2NA | |
| B. | 2molN2与6molH2在一定条件下反应生成的NH3 分子数一定大于2NA | |
| C. | 56gFe溶于过量稀硝酸,电子转移数一定等于3NA | |
| D. | 标准状况下,2.24 LCH3Cl含有的共价键数一定小于4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com