
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | | +2 | +1 | +5 | +7 | +1 | +5 |
| 最低负化合价 | -2 | | | -3 | -1 | | -3 |
科目:高中化学 来源:不详 题型:填空题
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化 |
| B.核外电子排布的周期性变化是元素性质周期性变化的本质 |
| C.元素周期表中可以把元素分成s、p、d、ds 四个区 |
| D.元素周期表中最外层电子数≤2的元素一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
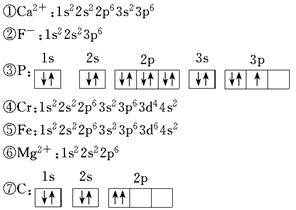
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物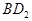 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。 的化学键类型是: .
的化学键类型是: .查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:HCl >HF >H2O | B.沸点:金刚石>冰>干冰 |
| C.碱性:NaOH >Mg(OH)2>Ca(OH)2 | D.元素的最高正化合价:F>S>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
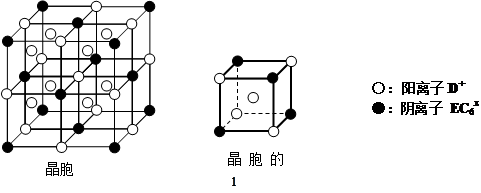
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SO4>HClO4 | B.碱性:NaOH>KOH |
| C.非金属性: P>S | D.气态氢化物稳定性: HCl>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com