
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |
分析 根据图1知,随着反应的进行,A和B的物质的量减少,C的物质的量增大,则A和B是反应物,C是生成物,
反应过程中,物质的量的变化量之比等于其计量数之比,所以A、B和C的计量数之比=(2.4-1.6)mol:(1.6-1.2)mol:(0.4-0)mol=0.8mol:0.4mol:0.4mol=2:1:1,当反应达到T3时,再升高温度C的含量降低,则正反应是放热反应,该反应的方程式为:2A(g)+B(g)?C(g)△H<0;
A.根据v=$\frac{△c}{△t}$计算平均反应速率;
B.当达到平衡状态后,升高温度平衡向吸热反应方向移动,根据C的含量变化判断反应热;
C.正反应是放热反应,温度越高K值越小;
D.化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂的比值.
解答 解:根据图1知,随着反应的进行,A和B的物质的量减少,C的物质的量增大,则A和B是反应物,C是生成物,反应过程中,物质的量的变化量之比等于其计量数之比,所以A、B和C的计量数之比=(2.4-1.6)mol:(1.6-1.2)mol:(0.4-0)mol=0.8mol:0.4mol:0.4mol=2:1:1,当反应达到T3时,再升高温度C的含量降低,则正反应是放热反应,该反应的方程式为:2A(g)+B(g)?C(g)△H<0.
A.0~4分钟时,A的平均反应速率v=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{2.4-1.6}{10}}{4min}$=0.02mol/(L•min),故A错误;
B.该反应正反应是放热反应,故B错误;
C.正反应是放热反应,温度越高K值越小,所以平衡后升高温度,K值减小,故C错误;
D.该反应方程式为:2A(g)+B(g)?C(g),),K=$\frac{c(C)}{{c}^{2}(A)•c(B)}$,故D正确;
故选D.
点评 本题考查了化学平衡图象的分析,正确推断可逆反应及反应热是解本题关键,注意图2中探究反应热时,必须是当反应达到平衡状态后再改变温度来确定反应热,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 3mol/L | C. | 4mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
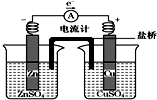
| A. | 盐桥是浸泡过KCl溶液的琼脂形成的,其中Cl-移向左池 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从铜片经导线流向锌片 | |
| D. | 铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
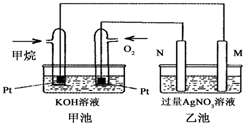 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氯气所含原子数目为NA | |
| B. | 2 L 0.2 mol/L K2SO4溶液SO42-物质的量浓度为0.4 mol/L | |
| C. | 1 mol Na作还原剂可提供电子数为NA | |
| D. | 同温、同压下NA个CO2分子和NA个O2分子的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com