
 ,Y的空间构型为V形.
,Y的空间构型为V形.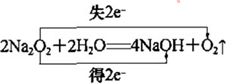 .
.分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,则C为O元素,C与F分别为同一主族,F为S元素,因D与F为同一周期,D是所在周期原子半径最大,推出D为Na元素,A与D为同一主族,A为H元素,E的氧化物是光导纤维的主要成分,可得E为Si元素,A、B、C三种元素可形成离子化合物的水溶液显酸性,推出B为N,据此分析解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,则C为O元素,C与F分别为同一主族,F为S元素,因D与F为同一周期,D是所在周期原子半径最大,推出D为Na元素,A与D为同一主族,A为H元素,E的氧化物是光导纤维的主要成分,可得E为Si元素,A、B、C三种元素可形成离子化合物的水溶液显酸性,推出B为N,
(1)A为H元素,C为O元素,两元素形成的化合物为H2O、H2O2,H2O2分解生成H2O,所以X是H2O2、Y是H2O,H2O2是共价化合物氧原子与氢原子之间形成1对共用电子对,氧原子与氧原子之间形成1对共用电子对,H2O2的电子式为 ,H2O的中心原子价层电子对数为2+$\frac{1}{2}$(6-2×1)=4,但又2对孤对电子对,故空间构型为V形;过氧化钠与水反应生成氢氧化钠和氧气,电子转移方向和数目表示为
,H2O的中心原子价层电子对数为2+$\frac{1}{2}$(6-2×1)=4,但又2对孤对电子对,故空间构型为V形;过氧化钠与水反应生成氢氧化钠和氧气,电子转移方向和数目表示为 ,
,
故答案为: ;V形;
;V形; ;
;
(2)E的氧化物是光导纤维的主要成分,为二氧化硅,请写出工业生产单质硅的化学反应方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)由H、N、O三种元素组成的离子化合物W,W的水溶液显酸性,则W为硝酸铵,硝酸铵溶液中,铵根离子水解NH4++H2O?NH3•H2O+H+,平衡水的电离平衡,溶液呈酸性,
故答案为:铵根离子水解得到氢离子:NH4++H2ONH3•H2O+H+;
(4)氢气与氧气在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,氢气在M极放电,发生氧化反应,碱性条件下生成水,故M极的电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O;
(5)在10L的密闭容器中,通入2mol SO2气体和1mol O2气体,一定条件下反应后生成SO3气体,发生反应2SO2+O2?2SO3,当反应达到平衡时,O2的浓度为0.01mol/L,参加反应的氧气为1mol-0.01mol/L×10L=0.9mol,根据方程式可知,平衡时参加反应SO2的物质的量为0.9mol×2=1.8mol,故二氧化硫的转化率为$\frac{1.8mol}{2mol}$×100%=90%,
故答案为:90%.
点评 本题考查结构性质位置关系、物质空间构型判断、盐类水解、原电池、化学平衡有关计算等,题目较为综合,难度不大,旨在考查学生对基础知识的理解掌握,推断元素是解题关键.


科目:高中化学 来源: 题型:选择题
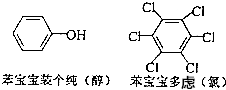 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如右图所示).则苯酚的二氯代物同分异构体数目是( )
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如右图所示).则苯酚的二氯代物同分异构体数目是( )| A. | 3 | B. | 4 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.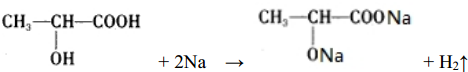 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
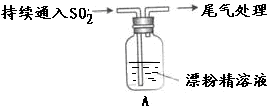 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1 mol•L-1 AlCl3溶液中加过量的6 mol•L-1 NaOH溶液可制备Al(OH)3悬浊液 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 向含有少量Fe3+的CuSO4溶液中加入铜片可除去Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-溴丙烷和2-甲基-2-溴丁烷 | |
| B. | 1,2-二甲苯和对二甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 1-丁烯和1,3-丁二烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com