
129 53 |
127 53 |
 ;反应③为氢原子和氯气反应,所以破坏的是氯气分子中的氯氯键,同一元素组成的双原子分子为非极性分子,所以破坏的是非极性共价键,
;反应③为氢原子和氯气反应,所以破坏的是氯气分子中的氯氯键,同一元素组成的双原子分子为非极性分子,所以破坏的是非极性共价键, ;非极性;
;非极性;

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、中性溶液中pD=7 |
| B、在1LD2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12 |
| C、在1L D2O中溶解 0.01mol DCl (设溶液的体积为1L),其中pD=2 |
| D、在100 mL 0.25mol/L的DCl重水溶液中加入100 mL 0.2 mol/L的 NaOD的重水溶液,其中pD=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
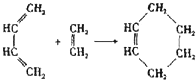 ( 也可表示为:
( 也可表示为: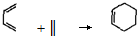 )
)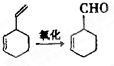
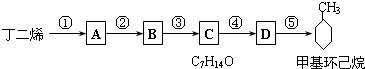
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、一定有乙烯 |
| B、一定有甲烷 |
| C、一定有丙烷 |
| D、一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(常温) |
查看答案和解析>>
科目:高中化学 来源: 题型:
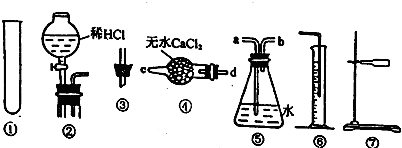
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位 于同一主族,Z、W位于同一周期;Y的最外层电子数是K层电子数的3倍;Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列司题:
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位 于同一主族,Z、W位于同一周期;Y的最外层电子数是K层电子数的3倍;Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列司题:查看答案和解析>>
科目:高中化学 来源: 题型:
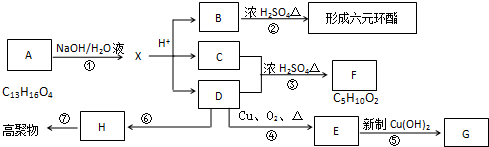
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com