
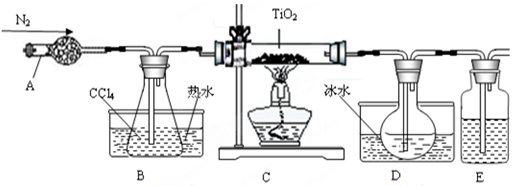
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
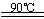 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)


科目:高中化学 来源:不详 题型:实验题
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 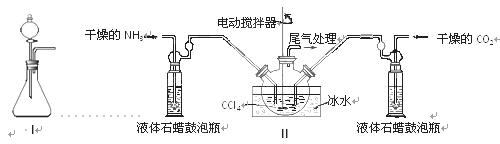
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
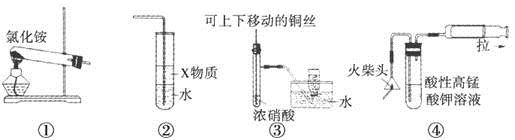
| A.用装置①可以制备氨气 |
| B.若装置②中X物质为苯,可用于实验室制备少量氨水,并防止发生倒吸 |
| C.装置③可用于制备并收集少量NO2气体 |
| D.装置④可用火柴头燃烧制备少量SO2,并检验产生的SO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
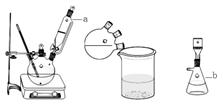
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
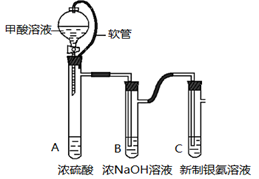
查看答案和解析>>
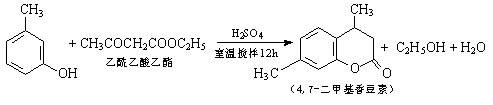
科目:高中化学 来源:不详 题型:填空题
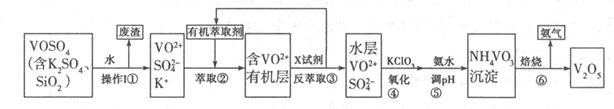
 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
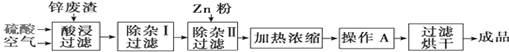
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com