
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
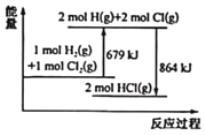
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:

(1)实验室制乙炔的化学方程式是:_________________;为了得到较为平稳的乙炔气流, 装置 A 的分液漏斗中常用______________来代替水.
(2)装置 B 中CuSO4溶液的作用是_______________________________.
(3)装置 D 中观察到的现象是 ___________________________________________
(4)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为_____(用m与n表示)。
(5)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是________________,___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是
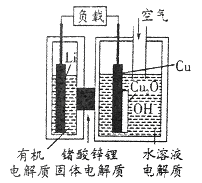
A. 正极为Li,负极为Cu
B. 放电时,正极的电极反应为:2Cu+2OH-+2e-==Cu2O+2H2O
C. Li极有机电解质可以换成Cu极的水溶液电解质
D. 通空气时,整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A.酸性:![]()
B.热稳定性:Na2 CO3![]() NaHCO3
NaHCO3
C.与水反应的速率:Na![]() Mg
Mg
D.非金属性:Cl![]() Br
Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。回答下列问题:
(1)20℃时,配制一组c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。
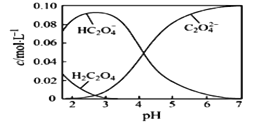
①H2C2O4的电离方程式为___________。
②为获得尽可能纯的NaHC2O4,pH应控制在_______左右。
③NaHC2O4溶液呈酸性,其原因为_________________。
④pH=6时,溶液中含碳微粒浓度大小关系为_______________。
(2)常温下,草酸、碳酸的电离平衡常数如下:
化学式 | H2CO3 | H2C2O4 |
平衡常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
①常温下,0.1 mol·L-1 Na2CO3溶液的pH____0.1 mol·L-1 Na2C2O4溶液的pH。(填“>”、“<”或“=”)
② pH=4的H2C2O4溶液中c(C2O42-):c(HC2O4-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | a | b | c |
工业上合成氨的反应 N2(g)+3H2(g) 2NH3(g) ΔH=_____kJ·mol-1.
(2)肼—空气燃料电池是一种环保型燃料电池,结构如图 1 所示
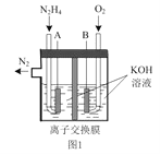
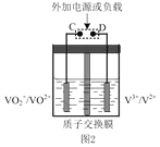
①肼—空气燃料电池的负极反应式为_____
②全钒液流可充电电池结构如图 2 所示,将肼—空气燃料电池的 A 极与全钒液流可充电电池的 C 极相连,B 极与 D 极相连,写出阴极的电极反应____
(3)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,与使用 Na2SO3 处理水中溶解的 O2 相比,肼的优点是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石与石墨是同素异形体。100 kPa时,1 mol石墨转化为金刚石的能量变化如图所示,下列说法正确的是

A.石墨转化为金刚石的反应为放热反应
B.石墨比金刚石更稳定
C.金刚石比石墨更稳定
D.破坏1 mol石墨的化学键所吸收的能量小于形成1 mol金刚石的化学键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com