
【题目】常温下,用0.lmolL-1的盐酸滴定10.0mL0.lmolL-1Na2A溶液,所得滴定曲线如图所示.下列说法正确的是
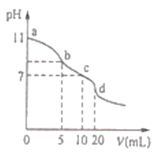
A.常温下,A2-的水解常数Khl(A2-)的数量级为10-6
B.b点溶液中:c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-)
C.c点溶液中:c(HA-)+c(A2-)+c(H2A)=0.lmolL-1
D.d点溶液中:c(A2-)+c(HA-)=c((H+)<c(OH-)
【答案】B
【解析】
A.0.lmolL-1Na2A溶液,pH=11,则Na2A为强碱弱酸盐,A2-+H2O![]() HA-+OH-,A2-水解程度比较小,则溶液中c(A2-) ≈ 0.lmolL-1,c(HA-) ≈ c(OH-)=
HA-+OH-,A2-水解程度比较小,则溶液中c(A2-) ≈ 0.lmolL-1,c(HA-) ≈ c(OH-)=![]() =0.001molL-1,常温下,A2-的水解常数Kh1(A2-) =
=0.001molL-1,常温下,A2-的水解常数Kh1(A2-) = ![]() =
= ![]() =10-5,A错误;
=10-5,A错误;
B.b点溶液中溶质为等物质的量浓度的NaHA、Na2A、NaCl,由电荷守恒可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HA-)+2c(A2-),由物料守恒可知,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)],由电荷守恒、物料守恒式子结合可知,b点溶液中:c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-),B正确;
C.c点溶液中溶质为等物质的量浓度的NaHA、NaCl,溶液的体积增大一倍,所以c(HA-)+c(A2-)+c(H2A)=0.05molL-1,C错误;
D.d点溶液中溶质为H2A、NaCl,溶液呈酸性,c((H+)c(OH-),D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】鲁米诺又名发光氨,是一种在犯罪现场检验肉眼无法观察到的血液。有机物B是一种常用工业原料,俗称苯酐,以其为原料可以合成非诺夫他林、鲁米诺等物质。
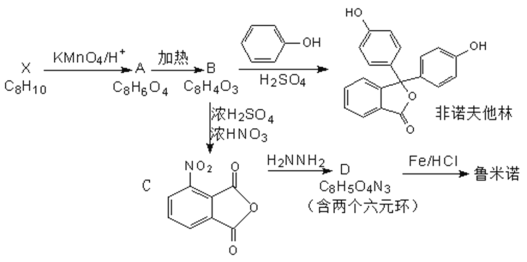
已知:①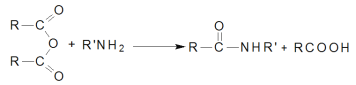
②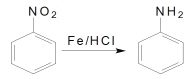
请回答以下问题:
(1)非诺夫他林的分子式是___,含有官能团的名称是___,1mol非诺夫他林最多可与____molNaOH反应。
(2)请写出下列化合物的结构简式:有机物A____;鲁米诺____。
(3)请写出B→C的反应类型:___;
请写出C→D的化学方程式____。
(4)有机物G的分子式为C9H8O4,它是有机物A最简单的同系物,请写出符合下列要求的G的所有同分异构体的结构简式___。
a.含有羧基和酯基官能团b.苯环上有两个对位取代基
(5)设计以邻甲基苯甲酸为原料合成 的流程图___(无机试剂任选)。
的流程图___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10g H2 和10g O2B.9g H2O 和0.5mol Br2
C.5.6L N2(非标准状况)和11g CO2D.224mLH2 (标准状况)和0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法工艺从阳极泥(主要含有Cu、Ag、Au)中提取Ag、Au的流程如图所示:
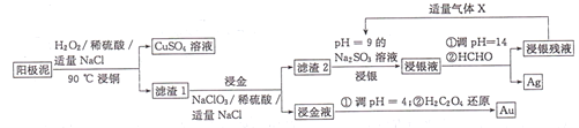
回答下列问题:
(1)“浸铜”时,铜参与反应的离子方程式为______________;若温度过高,铜的浸出率会降低,原因是______________。
(2)“浸金液”的主要成分是H[AuCl4],则“浸金”步骤发生反应的化学方程式为NaCl+NaClO3+Au+H2SO4→Na2SO4+H2O+H[AuCl4](未配平),该反应中氧化剂与还原剂物质的量之比为______________,“王水”也可溶解金,王水的成分为______________。
(3)从“浸金液”中提取金时氧化剂和还原剂的物质的量之比为______________。
(4)“浸银”时发生反应AgCl+2SO32-![]() Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:
Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:

从平衡移动角度解释上述曲线的变化原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙(Ca)、钾(K)、铁(Fe)和砷(As)以及少量镍(Ni)的新型化合物材料[CaK(Fe1-x一Nix)4As4).回答下列问题:
(1)基态镍原子的价层电子排布式为________,基态砷原子最高能级的电子云有________个伸展方向.
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的笫一电离能由小到大的顺序为________,[Fe(CN)6]4-中,铁提供的空轨道数目为________,气态化合物X与CN一互为等电子体,则X的化学式为________.
(3)AsCl3分子中砷的杂化类型为________;其空间构型为________。
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是________。
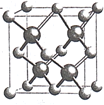
(5)镍和硫形成的某晶体.其晶胞如图所示.巳知该晶体密度为dgcm-3,NA为阿伏加德罗常数的值。则Ni、S原子最短核间距(D)为________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若mg Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则mg Na与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
A.仅①④B.仅①⑤C.仅③④D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com