
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
分析 由于白色化合物与碱溶液反应产生使酚酞试液变红色的气体,所以该物质属于铵盐;又该溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,所以产生的沉淀为硫酸钡,故对应的阴离子可以是硫酸根离子,也可以是亚硫酸根离子.
解答 解:由于白色化合物与碱溶液反应产生使酚酞试液变红色的气体,所以该物质属于铵盐,又该溶液用硝酸酸化后,再加入氯化钡溶液时,能生成沉淀,NH4Cl、(NH4)2CO3、(NH4)3PO4 不能生成沉淀,所以产生的沉淀为硫酸钡,故对应的阴离子可以是硫酸根离子,也可以是亚硫酸根离子,则X为选项中的(NH4)2SO3;
故选A.
点评 本题考查了铵盐性质、亚硫酸根离子的还原性,掌握离子性质是解题的关键,题目难度中等.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | +8QkJ/mol | B. | +16Q kJ/mol | C. | -8Q kJ/mol | D. | -16Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Cu | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
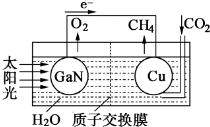
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要检杏是否漏水,可以用相同的方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的1/2 | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体一半透膜法分离提纯;悬浊液一过滤分离,本质上就是依椐所分离粒子的直径大小选择具有合适孔径的“筛子” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:O═O键键能为a kJ/mol、H-H键键能为b kJ/mol、水蒸气中H-O键能为c kJ/mol.又知:H2O(g)═H2O(l)△H=-d kJ/mol.则反应2H2 (g)+O2(g)═2H2O(l) 的△H为:(a+2b-4c-2d)kJ/mol | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测常温下NaHA溶液的pH.若常温下pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 常温下pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa)>c(NaOH) | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com