
| A. | 常温下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
分析 A.常温下,c(H+)=10-13mol•L-1的溶液,显碱性;
B.使pH试纸呈红色的溶液,显酸性;
C.加入铝粉有氢气生成的溶液,为非氧化性酸或强碱溶液;
D.常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液,为酸或碱溶液.
解答 解:A.常温下,c(H+)=10-13mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故A选;
B.使pH试纸呈红色的溶液,显酸性,Fe2+、I-均与NO3-发生氧化还原反应,不能共存,故B不选;
C.加入铝粉有氢气生成的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Mg2+、Cu2+,故C不选;
D.常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液,为酸或碱溶液,酸碱溶液中不能大量存在HCO3-,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
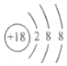

| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
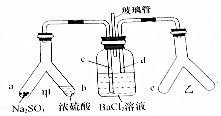 Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究.利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件,下列判断正确的( )| A. | 玻璃管的作用是连通大气,使空气中的氧气进人广口瓶,参与反应 | |
| B. | c、d两根导管郡必须插人BaCl2溶液中,保证气体与Ba2+充分接触 | |
| C. | Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀 | |
| D. | e、f两管中的试剂可以分别是浓氨水和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3 | B. | NaOH和Na2SO3 | C. | Na2SO3 | D. | Na2SO3和NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
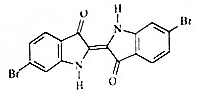 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )| A. | 属于烃的衍生物 | |
| B. | 分子式为C16H8O2N2Br2 | |
| C. | 1mol该有机物与H2加成最多消耗9molH2 | |
| D. | 该有机物溴元素检验可将有机物与碱液共热后,直接加入硝酸银溶液,观察是否有浅黄色沉淀生成. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
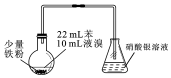
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 烧瓶中反应发生后,有白雾产生,继而充满红棕色气体 | |
| C. | 实验加入试剂的顺序可以是:苯、液溴、铁粉 | |
| D. | 为了增强验证HBr的实验效果,可将锥形瓶中的导管插入溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com