
| A. | SO2 | B. | NO | C. | NO2 | D. | NH3 |
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.常温下,向100gNaOH饱和溶液中加入0.39gNa2O2固体,恢复到常温,NaOH溶液的物质的量浓度一定不变
B.向一恒容容器中充入1molN2和1molH2,在一定条件下反应并达到平衡。升温,再次达到平衡状态,N2的体积分数一定不变
C.向50mL0.55mol/L的NaOH溶液中加入50mL0.50mol/L的稀盐酸,测定中和热,继续加入6mL等浓度的稀盐酸,测定的中和热一定不变
D.将2.3gNa投入100mL水中,产生H2,若在反应前向水中加入100 mL煤油,则产生H2的速率一定不变
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:填空题
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10?3mol·L?1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO | SO | NO | NO | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率__________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO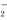 +2SO
+2SO ==2SO
==2SO +Cl?的平衡常数K表达式为__________。
+Cl?的平衡常数K表达式为__________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH?(aq)==SO (aq)+H2O(l)ΔH1
(aq)+H2O(l)ΔH1
ClO?(aq)+SO (aq)==SO
(aq)==SO (aq)+Cl?(aq)ΔH2
(aq)+Cl?(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO (aq)ΔH3
(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ClO?(aq)+2OH?(aq)==CaSO4(s)+H2O(l)+Cl?(aq)的ΔH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
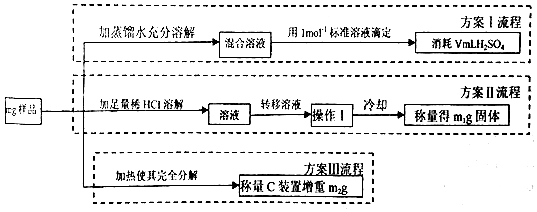
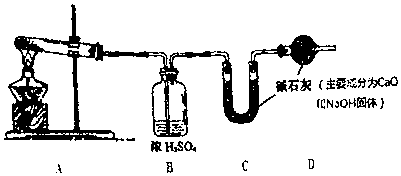
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁催化作用下,苯与溴水能发生取代反应 | |
| B. | 天然橡胶即聚2-甲基-1,3-丁二烯中含有大量碳碳双键,容易老化 | |
| C. | 有机物 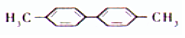 的一氯代物有5种 的一氯代物有5种 | |
| D. | 乙酸乙酯、油脂分别与热NaOH溶液反应均是皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| B. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| C. | 使用无铅汽油的汽车尾气不会污染空气 | |
| D. | 水体中植物营养物质过多积累会引起水体富营养化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com