
| A. | 位于第八周期,第ⅡA族 | |
| B. | 最高价氧化物对应水化物具有强碱性 | |
| C. | 此元素的原子半径较大,熔沸点很高 | |
| D. | 属于人造元素,自然界不存在,并具有放射性 |
分析 A、第118号元素位于元素周期表的第七周期、0族,由此推出位置;
B、对ⅡA元素,随着核电荷数增加,半径变大,金属性增强,所以最高价氧化物对应水化物的碱性增强;
C、对ⅡA元素,随着核电荷数增加,半径变大,熔沸点降低;
D、如果存在也是人造元素,具有放射性.
解答 解:A、第118号元素位于元素周期表的第七周期、0族,所以120号元素位于第八周期,第ⅡA族,故A正确;
B、对ⅡA元素钡,最高价氧化物对应水化物是强碱,所以120号元素最高价氧化物对应水化物具有强碱性,故B正确;
C、对ⅡA元素,随着核电荷数增加,半径变大,熔沸点降低,而不是升高,故C错误;
D、如果存在也是人造元素,具有放射性,故D正确;
故选C.
点评 本题考查元素的推断以及周期律的递变规律,题目难度不大,注意可根据第七周期最后一号元素的原子序数为118往后推断较为简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 | B. | CH≡CH | C. | CH3C≡CH | D. | CH2═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 纯碱可用于清洗油污 | |
| C. | 浓氨水可检验氯气管道泄漏 | |
| D. | 水玻璃是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH(l) | CO(g) | CH3COOH(l) |
| △H/kJ•mol-1 | -727 | -283 | -875 |
| A. | -135kJ/mol | B. | -331kJ/mol | C. | +135kJ/mol | D. | +148kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.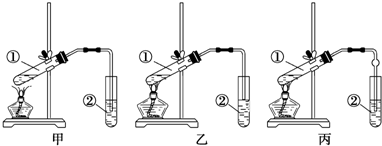
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
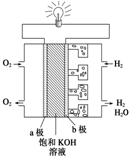 I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.
I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
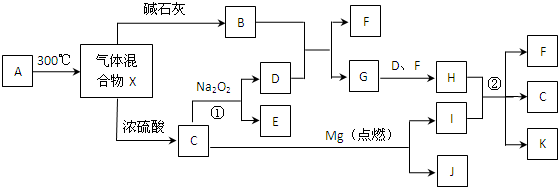
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com