
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NO分解反应NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)的平衡常数为1×10-30 | |
| B. | 根据K2的值可以判断常温下H2和O2很容易反应生成H2O | |
| C. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 | |
| D. | 温度升高,上述三个反应的平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐卤或石膏加入豆浆里制成豆腐 | |
| B. | 冶金厂利用高压直流电除去大量粉尘 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 在河水与海水的交界处,易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| B. | 加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 | |
| C. | 某溶液做焰色反应时火焰为黄色,则该溶液中一定有钠元素 | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
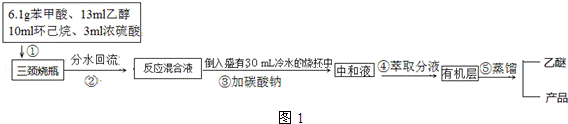
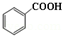 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$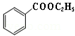 +H2O
+H2O| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环已烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环已烷、乙醇和水共沸物 | 62.1 |
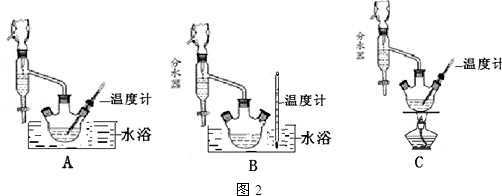
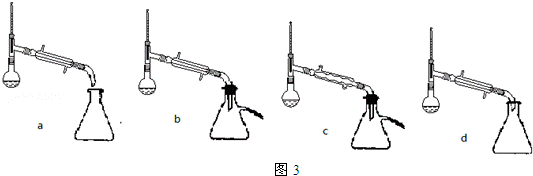
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com