
| A. | 同一能层的px、py、pz轨道电子能量相同 | |
| B. | 3d3表示3d能级有3个轨道 | |
| C. | p轨道电子能量不一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
分析 A.属于同一能层的P轨道,能量相同,形状相同;
B.d3中的3表示d能级上的电子个数;
C.没有指明p轨道电子和s轨道电子是否处于同一能层;
D.离核最近区域内运动的电子能量最低,离核越远区域内运动的电子能量越高.
解答 解:A.同一能层的px、py、pz,属于同一能层的P轨道,能量相同,形状相同,故A正确;
B.3d3中的3表示3d能级上的电子个数,故B错误;
C.同一能层中的p轨道电子的能量一定比s轨道电子能量高,但高能层中s轨道电子能量则比低能层中p轨道电子能量高,故C正确;
D.离核最近区域内运动的电子能量最低,离核越远区域内运动的电子能量越高,故D正确;
故选B.
点评 本题考查原子核外电子的排布,把握电子排布规律及能量的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:实验题
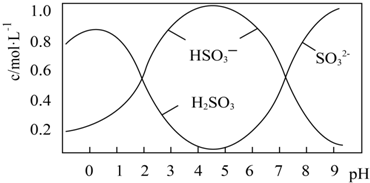
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入NaOH溶液 | B. | AlCl3溶液中加入足量的氨水 | ||
| C. | AlCl3溶液中加入石灰水 | D. | Al2O3溶于足量的热水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
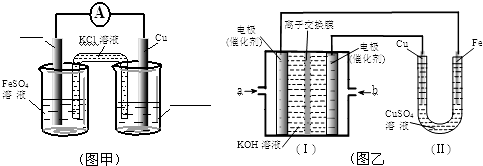
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始析出晶体后用玻璃棒搅拌 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 大于80% | C. | 小于80% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| B. | 标准状况下,11.2L溴单质含有NA个溴原子 | |
| C. | 常温常压下,28g乙烯和丙烯的混合气体含有的原子总数为6NA | |
| D. | 1mol乙醇与1mol乙酸混合充分反应后生成乙酸乙酯分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
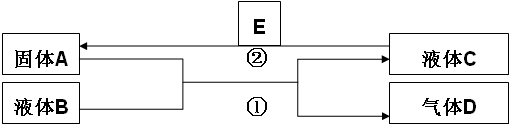
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com