
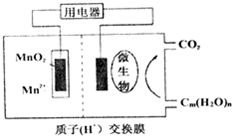
 关于如图微生物燃料电池结构示意图的说法:
关于如图微生物燃料电池结构示意图的说法:| A. | ④ | B. | ①③ | C. | ①④ | D. | ②③ |
分析 根据图知,碳水化合物失电子发生氧化反应生成二氧化碳,则右边装置中电极是负极、左边装置中电极是正极,电解质溶液呈酸性,正极上二氧化锰得电子和氢离子反应生成锰离子和水,所以正极反应式为MnO2+4H++2e-═Mn2++2H2O,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:根据图知,碳水化合物失电子发生氧化反应生成二氧化碳,则右边装置中电极是负极、左边装置中电极是正极,
①在微生物的作用微生物作用下,该装置为原电池装置,原电池能加快反应速率,所以可以说微生物的作用是促进电路中电子的转移,故正确;
②微生物所在电极区放电时失电子发生氧化反应,故错误;
③放电过程中,H+从负极区移向正极区,故错误;
④正极上二氧化锰得电子和氢离子反应生成锰离子和水,正极反应式为:MnO2+4H++2e-═Mn2++2H2O,故正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,侧重考查学生识图能力及对原电池原理的理解,明确各个电极上发生的反应及离子移动方向、电极反应式的书写是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 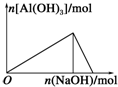 向AlCl3溶液中滴加NaOH溶液 | B. | 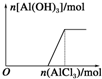 向NaOH溶液中滴加AlCl3溶液 | ||
| C. | 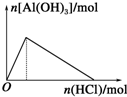 向Na[Al(OH)4]溶液中通入CO2 | D. |  向AlCl3溶液中滴氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.05NA个溴分子的CCl4溶液可以和1.12L乙烯恰好完全反应 | |
| B. | 标准状况下,11.2L的氯气分子参加氧化还原反应,转移的电子数目不一定是NA个 | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积大约为22.4L | |
| D. | 16gCH4与19gH3O+所含有的质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应:Na+2H2O═Na++H2↑+OH- | |
| D. | 过量二氧化碳与苛性钾反应:CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | HC≡CH | C. | CH2=C(CH3)2 | D. | HC≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com