
【题目】下表是不同温度下水的离子积数据:

试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”),作此判断的理由是______。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L﹣1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)在t2℃下,pH=10的NaOH溶液中,水电离产生的OH-为浓度为_________。
(4)t2℃下,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=________。
(5)有H+浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率大小顺序为_____;反应完全后生成H2的质量大小关系为____(用abc表示酸)。
【答案】 > 温度升高,Kw变大 103 10-10 9:11 a=b=c a=b<c
【解析】本题考查考查水的电离、水的离子积常数和pH的有关计算。(1)水是弱电解质,存在电离平衡,电离吸热;所以温度升高,水的电离程度增大,离子积增大;(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中c(Na+)=1×10-3mol/L.取该溶液1mL此溶液,钠离子浓度仍为1×10-3mol/L,稀释10倍,则钠离子浓度是1×10-4mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1;(3)在t2℃下,pH=10的NaOH溶液,c(H+)=1×10-10mol/L,水电离产生的OH-浓度为c(OH-)水=c(H+)水=1×10-10mol/L;(4)根据题意,t2℃下,即Kw=1×10-12,pH=11的NaOH溶液中OH-的物质的量浓度为c(OH-)=10-1,混合后pH=2,即酸过量,根据计算公式得∶![]() ,解得V1:V2= 9:11;(5)H+浓度大小影响生成氢气的反应速率,H+浓度相同,则开始时的反应速率相同,即a=b=c;醋酸为弱酸,不能完全电离,则H+浓度相同时酸的浓度最大,盐酸和硫酸都为强酸,H+浓度相同、溶液体积相同,则H+物质的量相同,则完全反应后生成H2的体积由大到小是c>a=b。
,解得V1:V2= 9:11;(5)H+浓度大小影响生成氢气的反应速率,H+浓度相同,则开始时的反应速率相同,即a=b=c;醋酸为弱酸,不能完全电离,则H+浓度相同时酸的浓度最大,盐酸和硫酸都为强酸,H+浓度相同、溶液体积相同,则H+物质的量相同,则完全反应后生成H2的体积由大到小是c>a=b。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在 5L 的密闭容器中发生如下反应:N2 (g)+3H2 (g)2NH3(g),起初充入的 3.0mol N2 和 6.0mol H2 , 5 分钟后达到平衡,此时容器内压强是开始时的 ![]() ,问:
,问:
(1)氢气的平衡转化率为;
(2)用氨气表示 5min 内的反应速率为
(3)若要使氮气和氢气的平衡转化率相等,起始投料要求 n(H2 ):n(N2 )为
(4)以下措施能加快反应速率的是
A.缩小体积,使压强增大
B.恒温恒容充入 He 使压强增大
C.恒温恒压充入 He
D.平衡后加入催化剂
(5)如果利用此反应设计成原电池,并用稀硫酸做电解液,分别写出正、负极的电极反应 式:、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途错误的是
A. 水玻璃可用作木材防火剂
B. 二氧化硅是制造光导纤维的材料
C. 石英是制造太阳能电池的常用材料
D. 石灰石和纯碱均是生产普通玻璃的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
(1)将钠、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(3)干燥管D的作用是 .
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶. 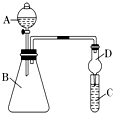
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
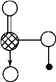
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B形成离子化合物A2B,A2B中所有粒子的电子数相同,A2B中电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:
(1)写出5种元素的名称:A、B、C、D、E .
(2)写出下列物质的电子式:D元素形成的单质;B与E形成的化合物;A、B、E形成的化合物;D、E形成的化合物 .
(3)A、B两元素组成的化合物A2B2属于(填“离子”或“共价”)化合物,存在的化学键是 , 写出A2B2与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:


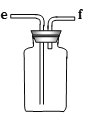
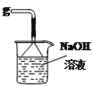
A B C D E
(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
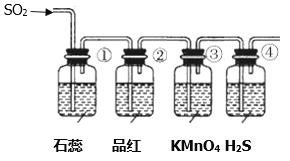
(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0g Na2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是________________________,样品中Na2SO3质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知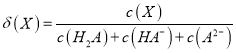 ]。
]。
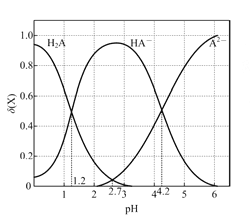
下列叙述错误的是
A. pH=1.2时,c(H2A)=c(HA-)
B. lg[K2(H2A)]=-4.2
C. pH =2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g )![]() CO2(g)+H2(g)在427℃时的平衡常数是9,如果反应开始时,一氧化碳和水蒸气的浓度都为1mol/L,5min达到平衡。计算:
CO2(g)+H2(g)在427℃时的平衡常数是9,如果反应开始时,一氧化碳和水蒸气的浓度都为1mol/L,5min达到平衡。计算:
(1)从反应开始到达到平衡时用H2表示的反应速率__________。
(2)CO的转化率___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com