
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-═BaSO4↓+H2O | |
| B. | 将稀硝酸滴加到氯化银固体上:AgCl+H+═Ag++HCl | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.H2SO41mol和1molBa(OH)2反应生成2mol水;
B.氯化银不溶于硝酸;
C.漏写生成碳酸氢根离子与碱的反应;
D.发生氧化还原反应生成锰离子、氧气、水.
解答 解:A.H2SO41mol和1molBa(OH)2反应生成2mol水,所以H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H+十SO42-═BaSO4↓+2H2O,故A错误;
B.氯化银不溶于硝酸,所以将稀硝酸滴加到氯化银固体上不发生反应,故B错误;
C.向碳酸氢铵溶液中加过量石灰水并加热的离子反应为Ca2++HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CaCO3↓,故C错误;
D.用酸化的高锰酸钾溶液氧化双氧水的离子反应为2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意氧化还原反应为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生无色无味且能使石灰水变浑浊的气体,该溶液一定含有CO32- | |
| B. | 用洁净的铂丝蘸取少量某溶液在无色火焰上灼烧,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中加入BaCl2溶液,有沉淀生成,再加入稀盐酸,沉淀不消失,该溶液一定含有SO42- | |
| D. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子流向:B电极→用电器→A电极→电解质→B电极 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 若用该电池在铁器上镀锌,电路中转移2 moI电子时,电镀池两电极质量差为65 g | |
| D. | 若用该电池电解精炼铜,负极减少7g时阳极减少质量为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取80.0g晶体用于配制溶液 | |
| B. | 将正确称取的晶体置于预先量取的500mL水中 | |
| C. | 定容前先将烧杯中溶解得到的溶液小心地直接倾倒至500mL规格的容量瓶 | |
| D. | 正确定容后,再将容量瓶塞盖好,反复上下颠倒,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.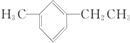 名称为1-甲基-3-乙基苯.
名称为1-甲基-3-乙基苯.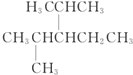 名称为:2,4-二甲基-3-乙基戊烷.
名称为:2,4-二甲基-3-乙基戊烷.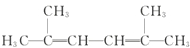 名称为:2,5-二甲基-2,4-己二烯.
名称为:2,5-二甲基-2,4-己二烯. ;
;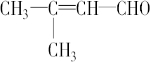 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
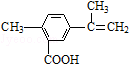
| A. | 在一定条件下,能发生取代、氧化和加聚反应 | |
| B. | 该物质分子中最多可以有11个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com