
【题目】含有A+ , B3+ , C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀: 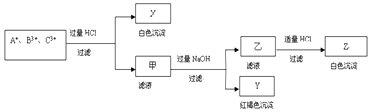
请通过分析回答(用化学符号填写):
(1)A+是 , B3+是 , C3+是;
(2)X是 , Y是 , Z是;
(3)写出下列离子方程式:
①生成Y沉淀:;②B3+与过量氨水反应:;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应: .
【答案】
(1)Ag+;Al3+;Fe3+
(2)AgCl;Fe(OH)3;Al(OH)3
(3)Fe3++3OH﹣═Fe(OH)3↓;Al3++3NH3?H2O═Al(OH)3↓+3NH4+
(4)2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】解:含有A+、B3+、C3+ 三种金属阳离子的水溶液,加入过量盐酸反应过滤得到白色沉淀X和滤液甲,白色沉淀只能是氯化银沉淀,说明A+离子为Ag+ , 滤液甲中加入过量氢氧化钠溶液过滤得到红褐色沉淀Y为Fe(OH)3 , 滤液乙中加入适量盐酸反应生成白色沉淀Z为Al(OH)3 , 其中B3+转入白色沉淀,则B3+、C3+ 离子分别为:Al3+、Fe3+ . (1)上述分析可知A+、B3+、C3+ 三种金属阳离子分别为:Ag+、Al3+、Fe3+ ,
所以答案是:Ag+;Al3+;Fe3+;(2)分析可知对应X、Y、Z分别为:AgCl、Fe(OH)3、Al(OH)3 ,
所以答案是:AgCl; Fe(OH)3;Al(OH)3;(3)①生成Y沉淀的离子方程式为:Fe3++3OH﹣═Fe(OH)3↓,
所以答案是:Fe3++3OH﹣═Fe(OH)3↓;
②Al3+与过量氨水反应生成氢氧化铝沉淀和铵根,离子方程式为:Al3++3NH3H2O═Al(OH)3↓+3NH4+ ,
所以答案是:Al3++3NH3H2O═Al(OH)3↓+3NH4+;(4)氢氧化铁分解产物是氧化铁,铝与氧化铁在高温下反应生成铁和氧化铝,放出大量的热,反应方程式为:2Al+Fe2O3 ![]() 2 Fe+Al2O3 ,
2 Fe+Al2O3 ,
所以答案是:2Al+Fe2O3 ![]() 2 Fe+Al2O3 .
2 Fe+Al2O3 .


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】第ⅡA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数可能为
A. x-nB. x+mC. x-mD. x+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫制作元素周期表时,许多元素尚未发现,他在铝的下面留了空位给“类铝”,并对“类铝”的性质进行了预测,“类铝”与后来发现的镓的性质一致,从而验证了元素周期表的正确性.下列有关镓的性质的描述中错误的是( )
A.镓的金属性比铝弱
B.镓的常见化合价为+3
C.镓的原子半径比铝大
D.镓的原子结构示意图为 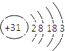
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( ) 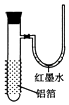
A.实验中发生的反应都是化合反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃0.1mol完全燃烧时生成11.2L CO2(标况下),则其化学式是_________。则该烷烃的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列说法正确的是( )
A.标况下,11.2L CO2与SO2的混合物含有氧原子数为2NA
B.常温下,0.9g H2O中,含有的电子数为0.5NA
C.标准状况下,2.24L CCl4所含的原子数为0.5NA
D.1molL﹣1的Na2SO4溶液中,含Na+的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是( )
A.金属原子的价电子数较少
B.金属晶体中存在自由移动的电子
C.金属晶体的原子半径较大
D.金属键不具有方向性和饱和性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为M g/mol,NA表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则 ![]() 表示的是( )
表示的是( )
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体的物质的量(以mol为单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里要配制400mL0.2mol/L的硫酸钠溶液。
(1)实验步骤如下:A.在天平上称出g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.把得到的溶液冷却后小心地沿着注入 中。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
E.将瓶塞塞紧,充分摇匀。
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
请填写上述空白处。
(2)下列情况会使所配溶液浓度偏低的是(填序号)。
a.某同学定容时观察液面的情况如图所示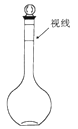
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线
d.B操作时将少量液体洒到外面
e.容量瓶用前内壁沾有水珠
(3)如果实验室用18mol/L的浓硫酸配制3. 6mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为mL,在实验时应用量取浓硫酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com