
 +CH3CHO
+CH3CHO| 一定条件 |
 +H2O,下列说法不正确的是( )
+H2O,下列说法不正确的是( )| A、肉桂醛的分子式为C9H8O |
| B、检验肉桂醛中是否残留有苯甲醛:加入酸性KMnO4溶液,看是否褪色 |
| C、1 mol肉桂醛在一定条件下与H2加成,最多消耗5 mol H2 |
| D、肉桂醛中所有原子可能在同一平面上 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2和NO |
| B、O2和 NO2 |
| C、NO和 NO2 |
| D、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
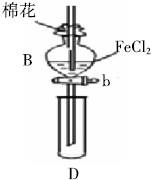 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:| 过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有SO42- |
| 乙 | 有Fe3+ 无Fe2+ | 有SO42- |
| 丙 | 有Fe2+ 无Fe3+ | 有Fe2+ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5a=(w2-w1 )V2 | ||
B、n(Al)>
| ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com