
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
科目:高中化学 来源: 题型:
【题目】I.现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
(1)从下表中选出正确选项______________


(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)______________。判断到达滴定终点的实验现象是_____________________________________。
(3)若滴定达终点时,滴定管中的液面如上图所示,正确的读数为__________
A.22.30 mL B.23.65 mL
C.22.35 mL D.23.70 mL
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
(5)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品的浓度是________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-221 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式为: _______________。
(2)工业上可以在恒容密闭容器中采用下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K=______。由上表数据判断,该反应的△H_______ 0(填“>”、“=”或“<”)。升高温度,正反应速率________填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为_______,此时的温度为_______。
③欲提高CO的转化率,可采取的措施是______ 。(填序号)
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物已省略)。
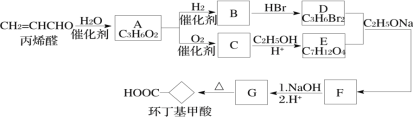
已知:
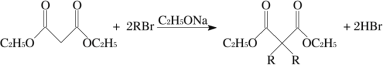
(1)
(2)![]()
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________。
(2)化合物C的结构简式是________________________。
(3)下列说法中正确的是___________(填字母代号)。
A.丙烯醛可以发生银镜反应 B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4 D.1mol化合物B与足量金属钠反应能生成1mol氢气
(4)写出D+E→F的化学方程式:__________________________________________。
(5)符合下列条件的G的同分异构体有____________种,写出其中在1H-NMR谱上显示两组峰且面积比为3∶1的结构简式:______________________。
①能使Br2/CCl4溶液褪色;②1mol G与1mol Na2CO3反应可以生成1mol CO2
(6)以1,3-丁二烯和化合物E为原料可制备![]() ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气可以制备大量的化工原料。请回答下列问题:
(1)由天然气制备合成气(CO和H2),进而可合成H2C2O4。
①欲加快H2C2O4溶液使5mL0.01mol/L酸性KMnO4溶液褪色,可采取的措施有__________、_______________(写两点)。
②下列可以证明H2C2O4是弱酸的是___________。
A.H2C2O4可以分解为CO、CO2和H2O
B.常温下,0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL
D.常温下,0.05mol/L的H2C2O4溶液pH≈4
(2)已知:①CO(g)+H2(g)![]() C(s)+H2O(g) △H1=-130kJ/mol
C(s)+H2O(g) △H1=-130kJ/mol
②CH4(g)![]() C(s)+2H2(g) △H2=+76kJ/mol
C(s)+2H2(g) △H2=+76kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H20(g) △H3=+41kJ/mol
CO(g)+H20(g) △H3=+41kJ/mol
则CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=________。
2H2(g)+2CO(g) △H=________。
(3)向2L容器中通入3molCO2、3molCH4,在不同温度下,以镍合金为催化剂,发生反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。

①高温下该反应能自发进行的原因是______________,930K时的平衡常数K=___________(保留两位小数)。
②请解释图中曲线随温度变化的原因______________。
③在700~1100K内,同温度下平衡转化率:CO2________CH4(填“大于”、“ 小于”或“等于”),结合(2)提供的反应分析,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。

已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)

(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为________mL。
![]()
(4)滴定。当______________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
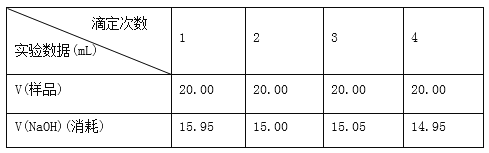
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号)。
a.pH b.沸点 c.电离常数 d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1的氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①NH3·H2O电离程度增大 ②c(NH3·H2O)增大 ③NH4+数目增多 ④c(OH-)增大
⑤溶液导电能力增强 ⑥![]() 增大
增大
A. ①⑤⑥ B. ②③④ C. ①③⑥ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com