
下列解释实验事实的方程式正确的是
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀: Al3++3OH- = Al(OH)3↓
B.90 ℃时,测得纯水中c(H+)·c(OH-) =3.8×10—13: H2O(l)  H+(aq)+OH-(aq) ?H<0
H+(aq)+OH-(aq) ?H<0
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2++SO42 -+ 4H+
D.碳酸钠溶液滴入酚酞变红:CO32 -+ 2H2O  H2CO3+2OH-
H2CO3+2OH-
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C.过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多。
D.久制的氯水PH值变小。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
(6分)氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1。请回答下列问题:
(1)甲与水反应的化学方程式是___________________________________。
(2)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式______________。
有人提出生成的产物Cu中可能还混有Cu2O,请设计实验方案验证之。(已知:Cu2O+2H+=Cu+Cu2++H2O)
______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
从淡化海水中提取溴的流程如下:

下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:填空题
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42 -等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:
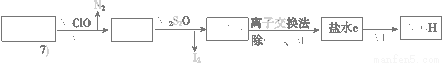
① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42 -。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
[化学一一选修2:化学与技术](15分)
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
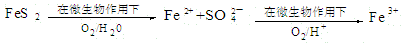
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为
;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________________________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:___________________________________________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是______ ________________________________________________________ 。
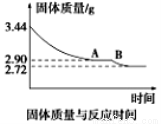
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
XeF4在水中的反应为:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列说法中正确的是
A.XeF4分子中各原子均达到8电子稳定结构
B.XeF4分子中Xe的化合价为0价
C.上述反应中氧化剂和还原剂的物质的量之比为2∶3
D.XeF4按上述方式水解,每生成4 mol Xe,转移16 mol电子
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO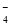 >Cl2>Fe3+ >I2
>Cl2>Fe3+ >I2
B.FeCl3既有氧化性又有还原性
C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3
D.FeCl3能使湿润的淀粉碘化钾试纸变蓝
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.1 mol Fel2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol/l硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4 NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com