
向一定物质的量的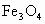 和Fe的混合物中加入
和Fe的混合物中加入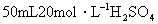 溶液,在一定条件下恰好使混合物完成溶解,放出448mL(标准状况)的气体.在所得溶液中加入KSCN溶液,无红色出现,那么用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量是多少?
溶液,在一定条件下恰好使混合物完成溶解,放出448mL(标准状况)的气体.在所得溶液中加入KSCN溶液,无红色出现,那么用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量是多少?
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:022
在一个容积不变的反应器中,要求调节体系的温度使下列反应达到平衡时,保持容器内气体的总物质的量为12mol。
已知反应A(g)+2B(g)![]() 2C(g),现向容器中加入6.5molA、xmolB、2.0molC。
2C(g),现向容器中加入6.5molA、xmolB、2.0molC。
(1)若x=5.5时,需要降低体系的温度使反应在平衡时达到题设条件,由正反应为 反应(填吸热或放热)。
⑵欲使起始反应维持向逆反应方向进行,则x的取值范围
。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比通入D和E两种气体(此时容器内气体的总物质的量不要求保持12mol),按下式反应:D(g)+E(g)![]() 2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入mmolD
、nmolF和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为 mol(设A、B、C与D、E、F之间均不反应)。
2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入mmolD
、nmolF和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为 mol(设A、B、C与D、E、F之间均不反应)。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
已知反应A(g)+2B(g)![]() 2C(g),现向容器中加入6.5molA、xmolB、2.0molC。
2C(g),现向容器中加入6.5molA、xmolB、2.0molC。
(1)若x=5.5时,需要降低体系的温度使反应在平衡时达到题设条件,由正反应为 反应(填吸热或放热)。
⑵欲使起始反应维持向逆反应方向进行,则x的取值范围
。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比通入D和E两种气体(此时容器内气体的总物质的量不要求保持12mol),按下式反应:D(g)+E(g)![]() 2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入mmolD
、nmolF和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为 mol(设A、B、C与D、E、F之间均不反应)。
2F(g),当反应达到平衡时,D在这三种物质中的体积分数为p%。若向容器中投入mmolD
、nmolF和一定量的E,在这三种物质新的平衡体系中,D的体积分数仍为p%。则投入E的物质的量为 mol(设A、B、C与D、E、F之间均不反应)。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。
SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。  2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。 
 2SO3(g)反应的图像中,正确的是______________。
2SO3(g)反应的图像中,正确的是______________。 
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省哈尔滨九中高三第三次月考化学试卷(解析版) 题型:解答题
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | Q1 | X1 | ||
| 乙 | 1 | 0.5 | Q2=39.4 | X2 | ||
| 丙 | 1 | 0.5 | 1 | Q3 | X3 | |
| 丁 | 1.8 | 0.9 | 0.2 | Q4 | X4 | |

| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com