
分析 (1)根据n=$\frac{m}{M}$计算二氧化锰物质的量,再根据方程式计算生成氯气、氯化锰的物质的量,根据V=nVm计算氯气的体积;
解答 解:8.7MnO2的物质的量=$\frac{8.7g}{87g/mol}$=0.1mol,100g×36.5%=36.5g,所以物质的量为:$\frac{36.5g}{36.5g/mol}$=1mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 4 1 1
0.1mol 1mol n(MnCl2) n(Cl2)
所以盐酸过量二氧化锰不足,
n(Cl2)=$\frac{0.1mol×1}{1}$=0.1mol
故标况下,生成氯气得到体积=0.1mol×22.4L/mol=2.24L,被氧化的氯化氢的物质的量为0.2mol,所以质量是0.2×36.5=7.3g;在反应后的剩余物中加入足量的AgNO3溶液,根据氯守恒生成硝酸银的物质的量为:1-0.2=0.8mol,所以 0.8mol×143.5g/mol=114.8g,
答:(1)生成标准状况下的氯气2.24L;
(2)被氧化的氯化氢的质量是7.3g;
(3)生成生成沉淀114.8g.
点评 本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 在导管口处点燃 | D. | 一定条件下与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
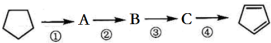
| A. | A的结构简式是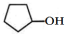 | |
| B. | ①②的反应类型分别是取代、消去 | |
| C. | 反应②③的条件分别是浓硫酸加热、光照 | |
| D. | 酸性KMnO4溶液褪色可证明  已完全转化成 已完全转化成  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 1:1 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  比较碳酸钠与碳酸氢钠的热稳定性 | B. |  称取NaOH | ||
| C. | 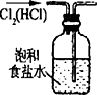 除去Cl2中HCl | D. | 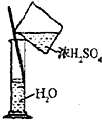 稀释浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使品红溶液褪色 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸用作干燥剂 | |
| D. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
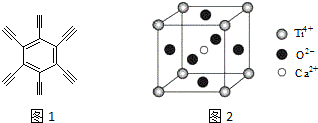
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
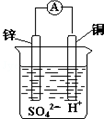
| A. | 电子从锌片经导线流向铜片 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 锌是负极,其质量逐渐减小 | D. | 溶液由无色变为蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com